Opakování anorganického názvosloví
Jak jste asi už pochopili, chemik se bez anorganického názvosloví prostě neobejde. Pevně věřím, že už jste se jej naučili v prvním ročníku, ale protože prázdniny byly dlouhé a opakování je matka moudrosti, radši si jej zopakujeme.
Pokud chcete, vyzkoušejte si, jak na tom jste. Zkuste rovnou pojmenovat či napsat vzorce následujících sloučenin. U příkladů s vykřičníky!!! se nenechte nachytat. Řešení naleznete na konci první podkapitoly.
| Pb(OH) 2 | peroxid vodíku |
| CoCl 2 . 6 H 2 O | dusitan strontnatý |
| SO 3 | hydrid draselný |
| H 2 CrO 4 | selenid sodný |
| NaClO | chloristan amonný |
| CuS | amoniak |
| P 4 O 10 !!! | kyselina siřičitá |
| HCl | hydroxid hořečnatý |
| CH 4 | fosforečnan lithný !!! |
| Ag 2 SiO 3 | kyselina boritá !!! |
Pokud se vám to příliš nedaří, nezoufejte. Nejprve je důležité si rozpomenout, co je oxidační číslo . Učili jsme se definici:
Definice: Oxidační číslo je rovno náboji, který by atom získal při úplné polarizaci svých vazeb v molekule či iontu.
Pro zopakování si nejprve vezmeme jednoduchou molekulu methanu CH 4 , kterou vidíte na obrázku na následující stránce. Dále budeme potřebovat hodnoty elektronegativity uhlíku a vodíku. Jestli si nepamatujete, co je to elektronegativita, tak to honem někde vyštrachejte, protože to je opravdu důležité. Třeba na straně 60 prvního dílu učebnice. Elektronegativity jednotlivých atomů jsou χ(C) = 2,5 a χ(H) = 2,2. Uhlík má tedy oproti vodíku elektronegativitu vyšší a je schopen si lépe přitahovat vazebné elektrony. V reálné molekule methanu je rozdíl elektronegativit obou prvků příliš malý, takže vazba C – H je ve skutečnosti nepolární, ale dle definice oxidačního čísla máme použít úplnou polarizaci vazeb. To znamená, že se máme na molekulu koukat tak, jako by obsahovala iontové vazby. Proto musíme všechny elektrony myšlenkově posunout na elektronegativnější prvek, kterým je v našem případě uhlík. Poté určíme náboje všech atomů. Tyto formální náboje jsou označovány jako oxidační čísla. Uhlík v methanu má tedy oxidační číslo –IV, protože by v přetahování s vodíky o elektrony čtyřikrát získal záporný elektron. Vodíky mají oxidační čísla +I, protože by své elektrony prohrály.
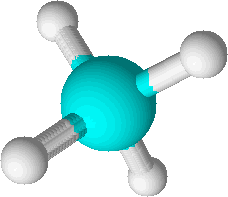
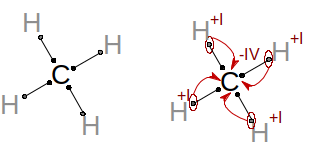
Odvození oxidačních čísel pro methan.
Zkusme ještě odvodit oxidační čísla atomů kyseliny fosforečné, přesněji trihydrogenfosforečné, H 3 PO 4 . Elektronegativity jednotlivých prvků jsou χ(P) = 2,1; χ(O) = 3,5 a χ(H) = 2,2. Nejelektronegativnější atomy kyslíku seberou elektrony, kde mohou, a budou mít oxidační číslo –II. Vodíci ztratí každý po jednom elektronu a budou mít oxidační číslo +I, fosfor přijde o pět elektronů a bude mít oxidační číslo +V, což této kyselině přisuzuje koncovku -ečná.
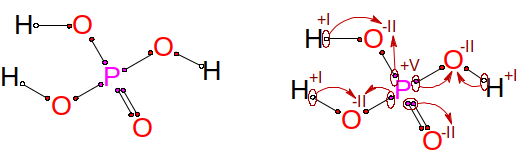
Odvození oxidačních čísel pro kyselinu fosforečnou.
V posledním příkladu si zkusíme odvodit oxidační čísla pro organickou sloučeninu, a to konkrétně pro ethanol, který možná znáte pod názvem líh. Elektronegativity atomů jsou χ(C) = 2,5; χ(O) = 3,5 a χ(H) = 2,2. Vyzkoušejte sami. Molekula ethanolu i výsledná oxidační čísla jednotlivých atomů jsou na obrázku.
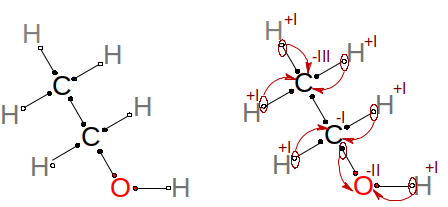
Odvození oxidačních čísel pro ethanol.
Dále jsme se učili tři principy názvosloví.
S 0 + O 2 0 → S IV O 2 -II
Jak síra, tak kyslík měly na počátku reakce oxidační čísla rovna nule. Na konci reakce se oxidační číslo síry změnilo na +IV a oxidační číslo kyslíku na –II.
Dále je šikovné si pamatovat prvky tvořící dvouatomové molekuly. Pokud budete potřebovat zapsat do rovnice reakce třeba vodík, píšete rovnou H 2 0 . Dvojka značí, že víte, že vodík tvoří dvouatomové molekuly, a nula v horním indexu značí, že oba vodíky v molekule vodíku mají oxidační číslo 0.
To samé platí i pro ostatní N 2 0 , O 2 0 , F 2 0 , Cl 2 0 , Br 2 0 , I 2 0 .
U jednoatomových iontů není rozdíl v oxidačním a nábojovém čísle. U víceatomových iontů v tom ale rozdíl je. Třeba zápis (SO 4 ) -II by znamenal, že anion odvozený od kyseliny sírové má oxidační číslo –II. To je ale nesmysl, protože oxidační čísla mají jednotlivé prvky. Správný zápis síranového anionu je (SO 4 ) -2 a znamená, že tato částice má náboj -2. Úzký vztah mezi nábojem a oxidačním číslem si můžeme ukázat na stejné částici. Když si spočítáme součet všech oxidačních čísel atomů v síranovém anionu, vyjde nám náboj této částice. (S VI O 4 -II ) -2 . Pro jistotu uvádím i výpočet: VI + 4 . (-II) = -2.
Řešení opakování:
|
Pb(OH) 2 |
hydroxid olovnatý |
H 2 O 2 |
peroxid vodíku, běžně používaná dezinfekce |
|
CoCl 2 . 6 H 2 O |
hexahydrát chloridu kobaltnatého |
Sr(NO 2 ) 2 |
dusitan strontnatý |
|
SO 3 |
oxid sírový, jeden z oxidů, který se podílí na kyselých deštích |
KH |
hydrid draselný |
|
H 2 CrO 4 |
kyselina chromová |
Na 2 Se |
selenid sodný |
|
NaClO |
chlornan sodný, který tvoří hlavní složku dezinfekčního prostředku SAVO |
NH 4 ClO 4 |
chloristan amonný, nezapomeňte, že amonný kation je NH 4 + . Svým kladným nábojem je přitahován k anionu soli. |
|
CuS |
sulfid mědnatý |
NH 3 |
amoniak, velice štiplavý plyn. Jeho molekula je bez náboje! |
|
P 4 O 10 !!! |
oxid fosforečný; vzpomeňte si, že fosfor nás trošku zlobí a tvoří dvojnásobky oxidů, než nám vyjde podle názvoslovných principů |
H 2 SO 3 |
kyselina siřičitá |
|
HCl |
chlorovodík |
Mg(OH) 2 |
hydroxid hořečnatý |
|
CH 4 |
methan; plyn, který je ve velké míře zodpovědný za globální oteplování. |
Li 3 PO 4 |
fosforečnan lithný !!!; Fosforečnany jsou soli kyseliny fosforečné, která tvoří ve své nejstálejší podobě molekulu H 3 PO 4 . Fosfor prostě zlobí. |
|
Ag 2 SiO 3 |
křemičitan stříbrný |
H 3 BO 3 |
kyselina boritá !!!; Bor taky trochu zlobí, ale vynahradí nám to jinde. Masti na bázi kyseliny borité se používají na jizvy a různá poranění. Její roztok, tzv. borová voda, se používá na záněty očí. |
2.1 Názvosloví dvouprvkových sloučenin
