Elektronegativita
Pozor vážení! Následující kapitola pojednává o elektronegativitě , která vás bude provázet celým vaším chemickým životem. Neznalost tohoto pojmu vám nejen značně zkomplikuje studium, ale je v chemických kruzích považována za zločin! Elektronegativita vysvětluje, proč je voda za normálních podmínek kapalná, proč se některé látky rozpouštějí v oleji a jiné ve vodě a mnoho, mnoho dalšího.
Definice: Elektronegativita je schopnost atomu přitahovat elektrony účastnící se chemické vazby.
Hodnoty elektronegativit jednotlivých prvků nalezneme v PSP a zapisujeme je následujícím způsobem. Třeba pro hodnotu elektronegativity dusíku píšeme χ(N) = 3,1. Řecké písmeno χ se jmenuje „chí“ a jak jste si jistě všimli, elektronegativita nemá jednotku.
Představme si dva atomy spojené jednoduchou vazbou, tedy jedním vazebným elektronovým párem.
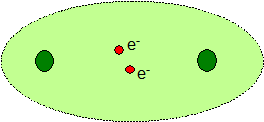
Nepolární vazba v molekule chlóru. Elektrony se nacházejí přibližně v polovině vzdálenosti mezi atomovými jádry chlorů.
Otázka k zamyšlení 13: Proč v PSP nenaleznete hodnoty elektronegativit pro vzácné plyny?
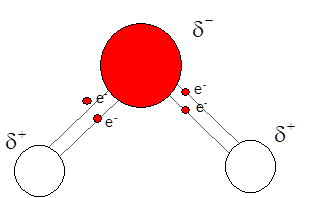
Polární vazby v molekule vody. Elektrony obou vazeb budou blíže elektronegativnějšímu atomu kyslíku a vytvoří na něm malý (parciální, částečný) náboj.
Ověřte, zda je vazba mezi kyslíkem a vodíkem v molekule vody opravdu polární. Tedy najděte si hodnoty elektronegativit kyslíku a vodíku, odečtěte je a porovnejte s uvedeným intervalem.
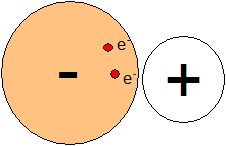
Iontová vazba je spojena se vznikem anionu z elektronegativnějšího atomu a kationu z atomu elektropozitivnějšího.
Asi nás nepřekvapí, že typ vazby významně určuje vlastnosti a chemické chování sloučeniny. Elektronegativita je tabelovaná veličina. V PSP ji najdete u značky prvku nebo na druhé straně tabulky. Když si hodnoty jednotlivých prvků pořádně prohlédnete, všimnete si určitých trendů. Hodnoty elektronegativity klesají ve skupinách směrem dolů a v periodách zprava do leva. Nejelektronegativnější prvek je tedy fluor. Hodnota jeho elektronegativity je 4. Nejméně elektronegativní (nejelektropozitivnější) prvky nalezneme v okolí cesia a francia.
Odpověď 13: Elektronegativita může být stanovena, jak vyplývá již z její definice, pouze pro prvky, které se váží vazbou k jiným prvkům. Vzácné plyny prakticky netvoří žádné sloučeniny, tedy není možné jejich elektronegativitu stanovit.
Další kapitola:5.3 Koordinačně – kovalentní vazba
