Oddělování homogenních směsí
Rozdělit heterogenní směs ještě není takový problém. Částice jednotlivých složek se přeci jenom dost liší a my toho můžeme využít. Rozdělit homogenní směs je podstatně větší výzva, na kterou budeme potřebovat sofistikovanější postupy.
Krystalizace.
Pokud budu roztok zahřívat, rozpouštědlo se bude odpařovat. Rozpuštěná látka má postupem času kolem sebe méně a méně částic rozpouštědla. Hraniční okamžik je stav tzv.
nasyceného roztoku
. To je moment, kdy je v roztoku rozpuštěno maximální množství rozpuštěné látky. Pokud i nadále budu v zahřívání pokračovat, rozpouštědla už bude tak málo, že se rozpuštěná látka do roztoku „nevejde“ a vysráží se v podobě krystalu.
Extrakce.
Tato metoda, která se hojně využívá v biologii a obecně při práci s nějakým biologickým materiálem, je založena na sérii vzájemně nemísitelných rozpouštědel. Představme si, že máme oddělit tři složky X, Y, Z rozpuštěné ve vodě. Nejprve použijeme rozpouštědlo 1, o kterém víme, že se s vodou nemísí a zároveň se v něm složky X a Y rozpouští mnohem lépe než ve vodě. Po oddělení v dělící nálevce máme složku Z zakoncentrovanou ve vodě a X a Y v rozpouštědle 1. Nyní je čas na rozpouštědlo 2, o kterém víme, že se s rozpouštědlem 1 nemísí a zároveň složka X se v něm rozpouští mnohem lépe, zatímco Y prakticky vůbec v porovnání s rozpouštědlem 1. Po oddělení na dělící nálevce máme rozdělené všechny složky. Pro lepší představu si prohlédněte obrázek.
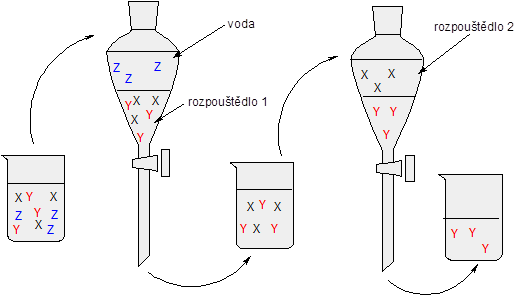
Schématické znázornění extrakce.
Situace je ve skutečnosti, jako obvykle, mnohem složitější. Je nutné jednotlivé kroky mnohokrát opakovat, roztoky v dělící nálevce řádně protřepat a ani pak není oddělení složek úplné. Extrakce se běžně používají při zpracování tuků a olejů nebo třeba přírodních barviv.
Destilace.
Princip této metody je založen na různých teplotách varu jednotlivých složek směsi. Běžná destilační aparatura je uvedena na obrázku. Pokusíme se oddělit složky X a Y s tím, že tv(X) je vyšší než tv(Y). Poté, co zapneme topné hnízdo, se začne roztok zahřívat – začne mu stoupat teplota. Po chvilce teplota roztoku dosáhne tv(Y) a složka Y začne vřít. Složka X je stále v roztoku. Aparatura se postupně začne plnit párami složky Y, tyto páry se dostanou až do chladiče, který je zchladí. Páry Y poté zkondenzují na stěnách chladiče a stečou do připravené baňky. Složky X a Y jsou oddělené.
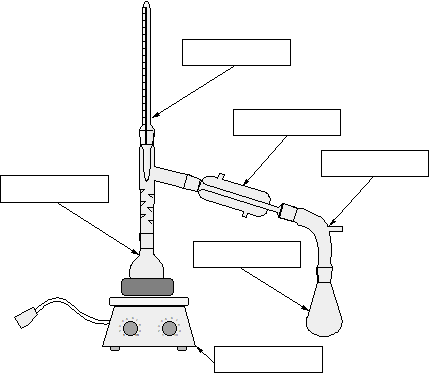
Doplňte názvy jednotlivých součástí destilační aparatury.
Kromě základního uspořádání destilace, existují i různé úpravy, které se používají pro specializované procesy. Pokud bychom měli v destilační baňce několik složek s velmi podobnou teplotou varu, jeden destilační krok by nestačil. Destilaci bychom museli několikrát opakovat. Mnohonásobně opakovaná destilace se nazývá
rektifikace
a používá se např. pro zpracování ropy (rozdělení ropy na benziny, naftu, oleje a další složky). Pokud bychom měli v roztoku složky, které mají vysokou teplotu varu, destilace by byla problematická. Vysoká teplota by byla energeticky náročná a také by mohla způsobit zničení pro nás zajímavých látek. V takovém případě se používá
destilace za sníženého tlaku.
Jak už jsme si řekli, teplota varu je závislá na vnějším tlaku. Když budeme z aparatury odsávat páry, tedy snižovat tlak, sníží se i teploty varu destilujících složek. Nu a je to. Problém vyřešen. Poslední variantou, kterou se naučíme, je
destilace s vodní parou
. Pokud potřebujeme oddělit málo těkavé látky, použijeme jiný trik. Přidáme do destilační aparatury baňku s vodou, kterou přivedeme k varu. Molekuly vodní páry, a že jich bude hodně, budou sebou strhávat molekuly naší málo těkavé látky a tím významně usnadní jejich destilaci. Situaci si můžete představit tak, že jedete v přeplněném metru. Taky vás často strhnou ostatní cestující (molekuly vody) a vy musíte vystoupit, aniž byste to předtím plánovali.
Chromatografie.
Poslední separační metoda, se kterou se seznámíme, je založena na různé schopnosti složek směsi zadržovat se na pevné fázi. Následkem čehož jsou látky unášeny rozpouštědlem různými rychlostmi, což vede k jejich oddělení. Cože???? Zkusme si to popsat konkrétněji. Máme pevnou (tzv. stacionární) fázi, kterou může být speciální papír nebo třeba obyčejná školní křída. Pak máme fázi pohyblivou (tzv. mobilní), která je tvořena nějakými rozpouštědly, třeba ethanolem, nebo směsí rozpouštědel. Nyní na stacionární fázi naneseme vzorek, jehož složky chceme rozdělit, a ponoříme okraj stacionární fáze do fáze mobilní. Mobilní fáze bude vzlínat po fázi stacionární, až se dostane k našemu vzorku. Nyní nastává vlastní separační fáze. Protože každá složka vzorku je trochu jiná, bude se různě pevně „držet“ fáze stacionární. Interakce mezi složkou vzorku a stacionární fáze může mít různou fyzikální podstatu a není to pro nás nyní podstatné. Důležité je, že ty složky, které se „drží“ pevně, půjdou s mobilní fází pomalu, ty co se „drží“ slabě, pojedou rychle. A právě tento rozdíl vede k jejich rozdělení.
Chromatografie je v současnosti jedna z nejpoužívanějších separačních metod. Profesionální přístroje již dávno nejsou založeny na křídě a ethanolu a jsou schopny rozdělit desetitisíce složek v řádu minut. Současná biochemie, medicína a farmacie by se bez chromatografie jen těžko obešly.
 Moderní chromatografický přístroj, který je schopen v řádu minut rozdělit stovky látek.
Moderní chromatografický přístroj, který je schopen v řádu minut rozdělit stovky látek.
Úkol: Naučte se následující chemické nádobí. Vaše první laboratorní práce se blíží.
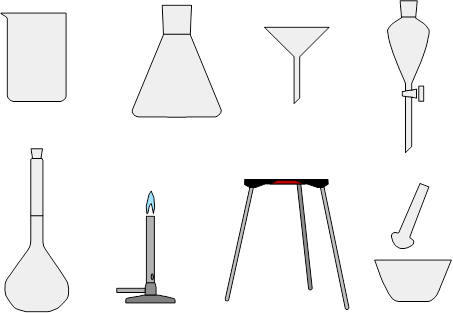
Pozor, v chemii, stejně jako v jiných oborech, jsou určité termíny/pojmy/názvy, na kterých si chemici zakládají, ale běžný smrtelník pro to nemá pochopení a plete je. Pokud nechcete chemiky zlobit, tak říkejte nálevka (nikoliv trychtýř), třecí miska s tloučkem (nikoliv hmoždíř s paličkou) a výlevka (nikoliv dřez). Děkujeme.
Další kapitola:
3.2.3 Voda


 Moderní chromatografický přístroj, který je schopen v řádu minut rozdělit stovky látek.
Moderní chromatografický přístroj, který je schopen v řádu minut rozdělit stovky látek.

