Výpočty ze vzorců
Pokud analytickému chemikovi donesete úplně neznámý vzorek s otázkou, co to tak může být, asi začne nadávat a vyžene vás. Pokud ho však přesvědčíte, že to opravdu potřebujete, pustí se do práce. Jedna z prvních analýz, kterou provede, se nazývá elementární analýza . Výsledkem elementární analýzy je informace o tom, jaké jsou ve vzorku přítomny prvky a v jakém hmotnostním poměru jsou zastoupeny. Představte si třeba, že víte, že váš vzorek obsahuje 77,8 % železa a 22,2 % kyslíku. První myšlenka, která vás napadne, je, že se jedná o oxid železa. Asi ano, ale jaký? Známe oxid železnatý FeO nebo oxid železitý Fe2O3. Pojďme si nad tím trochu zapřemýšlet.
Představme si, že máme vzorku 1 g. Hmotnost vzorku si můžeme určit libovolně. Každé námi vybrané množství bude mít přeci stejné složení.
S 1 g se ale nejlépe počítá, jak si můžete všimnout na následujícím příkladu.
Jaké budou hmotnosti jednotlivých prvků obsažených ve vzorku? Na to máme vzorečky.
w(Fe) = 0,778
w(O) = 0,222
mvzorek= 1 g
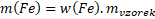
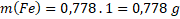
Hmotnost kyslíku vypočítáme analogicky, anebo jednodušeji odečteme hmotnost železa od hmotnosti vzorku.
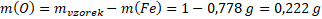
Nyní již víme, že ve vzorku máme 0,778 g železa a 0,222 g kyslíku. Jak ale víme, chemický vzorec nevyjadřuje poměr hmotností atomů, ale poměr jejich počtu. Musíme tedy hmotnosti jednotlivých prvků přepočítat na nějakou veličinu, která vyjadřuje jejich počet. Látkové množství je jasná volba.
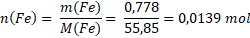
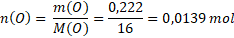
V našem vzorku je 0,0139 molu železa a 0,0139 molu kyslíku. Vidíme, že železa a kyslíku je ve vzorku stejně. Vyjádříme-li to poměrem, tak je to 1 : 1 a vzorcem pak FeO. Neznámý vzorek je oxid železnatý.
Příklad: Elementární analýza neznámého vzorku poskytla následující složení uvedené v hmotnostních procentech 0,99 % H; 35,29 % Cl; 63,72 % O. Určete, o jaký vzorek se jedná.
Zvolíme si hmotnost vzorku 1 g.
Hmotnosti jednotlivých prvků obsažených ve vzorku jsou:
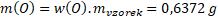
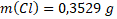
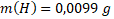
Látková množství prvků obsažených ve vzorku jsou:
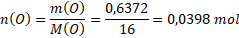
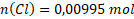
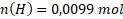
Nyní určíme, v jakém poměru jsou prvky zastoupeny. V tomto případě to není na první pohled patrné. Spočítáme to tak, že vydělíme nejnižším látkovým množstvím všechna ostatní.
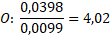
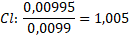
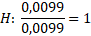
Nenechte se zmást „drobnými“ odchylkami, které jsou obvykle zapříčiněny zaokrouhlováním nebo molárními hmotnostmi z různých zdrojů. Teď zbývá jen prvky nějak rozumně seřadit. Náš neznámý vzorek je HClO4. Jakpak se nazývá tato sloučenina?
Další příklady na procvičení:
Další kapitola:
7.3 Přepočty koncentrací
