Chemická reakce
Již poměrně dlouho se zabýváme chemií. Pracujeme s látkami, některé umíme nazvat, známe jejich vlastnosti a už téměř automaticky používáme pro přeměnu jedněch látek na druhé termín chemická reakce . V následující kapitole si znalosti o chemických reakcích trochu učešeme, ale většina kapitoly již pro vás bude opakováním.
Definic chemické reakce jistě najdete celou řadu. Netřeba si situaci komplikovat, uvedeme si tu nejjednodušší z nich.
Definice: Chemická reakce je děj, při kterém dochází v částicích reagujících látek k zániku některých vazeb a ke vzniku nových.
Pro popis chemických reakcí se používají chemické rovnice a dále několik pojmů. Chemickou rovnici a její popis si ukážeme na příkladu Haber-Boschovy syntézy amoniaku, reakce, která zachránila svět před hladomorem.
stechiometrické koeficienty
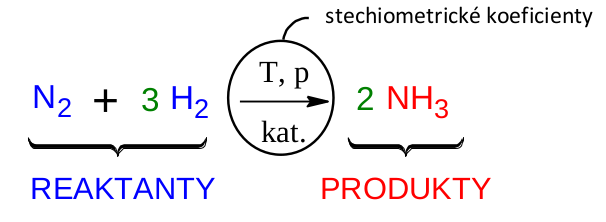
Látky na levé straně rovnice se nazývají výchozí látky či reaktanty . Tyto látky se přeměňují reakcí a postupem času jich bude ubývat. Šipka znázorňuje chemickou přeměnu. Látky na pravé straně rovnice se nazývají produkty a reakcí vznikají. Dále rovnice obsahuje stechiometrické koeficienty . Tato čísla jsou mimořádně důležitá, protože nás informují, v jakých poměrech jednotlivé látky reagují či vznikají. V našem příkladu se musí potkat jedna molekula dusíku hned se třemi molekulami vodíku, zreagují spolu a atomy se přeuspořádají tak, že vzniknou dvě molekuly amoniaku. Když si to přepočítáte, zjistíte, že počet atomů daného prvku na levé straně se rovná počtu těchto atomů na straně pravé. Proto pojem rovnice používáme zcela oprávněně. Žádný atom jsme při reakci neztratili. Jenom jsme atomy přeuspořádali do molekul produktů. Doplňovat stechiometrické koeficienty, tedy vyčíslovat chemické rovnice, se naučíme v následujících kapitolách. Jistě jste si všimli, že před molekulou dusíku není žádný stechiometrický koeficient uveden. Je to proto, že se jedničky obvykle nepíší, ale snadno si je domyslíme.
Chemická rovnice nemusí nutně znázorňovat mechanismus děje. Mechanismus děje ukazuje, co přesně se musí stát, co s čím se musí srazit, jaké vazby zanikají nejdříve apod. U jednoduchých reakcí jejich mechanismus opravdu odpovídá rovnici reakce. U komplikovanějších dějů rovnice pouze ukazuje, s jakými látkami reakce začíná a na jakých končí. Jednotlivé dílčí mezikroky z ní nepoznáme.
Otázka k zamyšlení 7: Proč zrovna tato reakce, Haber – Boschova syntéza, která umožňuje ve velkém množství produkovat amoniak, zachránila svět před hladomorem?
Fritz Haber je pozoruhodná a rozporuplná osobnost. Do světových dějin se zapsal několikrát. Předně objevil metodu, Haber-Boschovu syntézu, pro snadnou výrobu amoniaku ve velkém množství. Podílel se však i na vývoji bojových plynů a některých bitev první světové války, nejslavnější byla patrně ta u belgické obce Ypres, se i osobně zúčastnil. Jeho válečná angažovanost měla dva následky. Haberova manželka psychicky neunesla manželovy aktivity a zastřelila se jeho pistolí na dvoře jejich vily. Druhým následkem bylo to, že po konci války byl Haber obviněn z válečných zločinů, a dokonce se musel po určitou dobu skrývat. Jeho válečné aktivity nicméně nezabránily Nobelově komitétu udělit mu Nobelovu cenu za chemii. Další z jeho objevů byl tzv. Cyklon B. Haber vymyslel způsob, jak bezpečně vyrábět a uskladňovat prudce jedovatý kyanovodík. Původním jeho úmyslem bylo, že se tento plyn bude moci používat proti škodlivým hlodavcům. O tom, jak s touto látkou naložilo Hitlerovské Německo, se již Haber nedozvěděl. Zemřel v roce 1934 ve Švýcarsku, kam se jako Žid uchýlil. Velká část jeho rodiny však v Německu zůstala a byla zavražděna v koncentračních táborech právě touto látkou.
Odpověď 7: Amoniak je vstupní surovina pro výrobu dusíkatých hnojiv. Obrovský nárůst populace kladl značné nároky na hospodářskou produkci. Levná dusíkatá hnojiva proto byla, a dodnes jsou, naprosto nezbytná.
Další kapitola:6.1 Dělení chemických reakcí
