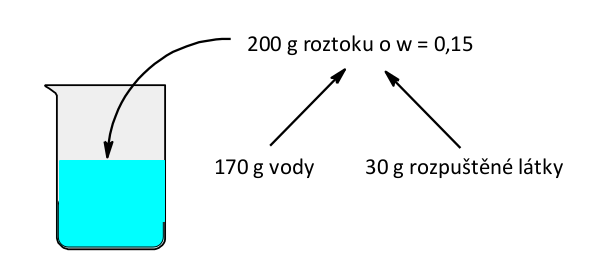
Opakování základních veličin
Nejprve jsme se naučili pracovat s hmotnostním zlomkem . Hmotností zlomek nám říká, jakou část hmotnosti roztoku tvoří rozpuštěná látka a jakou rozpouštědlo, kterým je obvykle voda. Pokud máme třeba 15% roztok, jinými slovy roztok, který má hmotnostní zlomek w = 0,15, znamená to, že tento roztok je z 15-ti % tvořen rozpuštěnou látkou a zbytek, 85 % je rozpouštědlo. Pro příklad 200 g nějakého 15% roztoku bude tvořeno z 30 g rozpuštěné látky a 170 g rozpouštědla.
Pojďme to dát do vzorečků. Základní vztah pro hmotnostní zlomek je
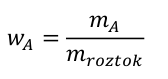
kde w A je hmotnostní zlomek složky A, m A je hmotnost látky A v roztoku a m roztok je hmotnost celého roztoku. Obě hmotnosti musí být uvedeny ve shodných jednotkách, aby se jednotky vykrátily a hmotnostní zlomek byl bezrozměrný. Dále platí, že součet hmotnostních zlomků všech složek roztoku je roven jedné. Náš příklad v číslech by vypadal takto
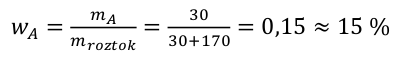
Jak tedy budete postupovat, když budete v laboratoři potřebovat připravit třeba 5% roztok manganistanu draselného?
Nejprve se zamyslíte, kolik roztoku budete potřebovat, a stanovíte si jeho hmotnost. Pokud potřebujete pár kapek, bude vám stačit třeba jen 10 g. Pokud ho budete potřebovat více, tak musíte přitlačit. Dospěli jste k názoru, že jej budete potřebovat třeba 50 g. Roztok má být pětiprocentní. Kolik manganistanu je třeba navážit? Přeci 5 % z 50 g, což je 2,5 g. Kolik vody na rozpuštění? 47,5 g, což je 47,5 ml. Vzorečky by to vypadalo následovně.
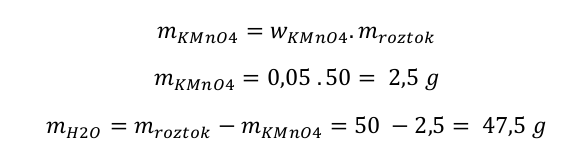
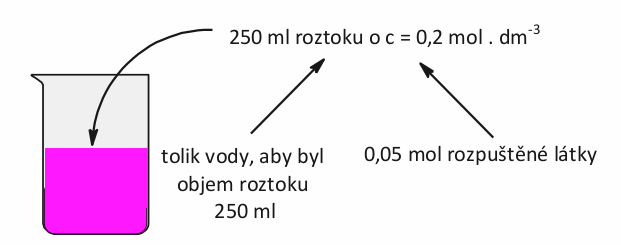
Dále jsme se učili o molární koncentraci. Tato veličina nám říká, jaké látkové množství rozpuštěné látky najdeme v jednom litru roztoku. Pokud bude mít roztok koncentraci c = 0,2 mol . dm -3 , znamená to, že v jednom litru takového roztoku plave 0,2 mol rozpuštěné látky. Ve 250 ml tohoto roztoku najdeme 0,05 mol rozpuštěné látky apod.
Základní vztah pro molární koncentraci je
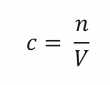
kde c je molární koncentrace v mol . dm -3 , n je látkové množství v molech a V je objem v litrech.
Běžný problém v laboratoři. Potřebujete připravit 250 ml roztoku třeba dusičnanu stříbrného o molární koncentraci c = 0,025 mol . dm -3 . Jak na to? Nejprve si spočítáme látkové množství dusičnanu.
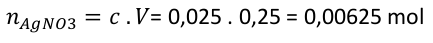
Dusičnan budeme vážit, proto je potřeba látkové množství dusičnanu přepočítat na hmotnost. K výpočtu bude potřeba jeho molární hmotnost, kterou si zjistíme z tabulky. M(AgNO 3 ) = 169,87 g . mol -1
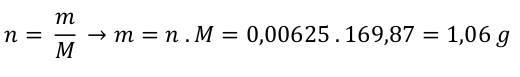
Musíte navážit 1,06 g dusičnanu stříbrného. Poté ho rozpustíte v trošce destilované vody a doplníte vodou po rysku odměrné baňky na požadovaný objem 250 ml.
Poslední vztah, který by se mohl hodit, je vztah pro přepočet hmotnostního zlomku na molární koncentraci a obráceně.
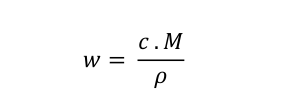
kde w je hmotnostní zlomek, c je molární koncentrace v mol . dm -3 , M je molární hmotnost v g . mol -1 a ρ je hustota v g . dm -3 .
Příklady pro procvičení:
- Jakou hmotnost chloridu draselného navážíte pro přípravu 120 g jeho roztoku o w (KCl) = 0,15? V kolika ml vody bude třeba sůl rozpustit? (18 g KCl, 102 ml vody)
- ý hmotnostní zlomek bude mít dusičnan draselný v roztoku, který byl připraven z 12 g této soli a 150 ml vody? (w(KNO 3 ) = 0,074)
- Určete hmotnostní zlomky jednotlivých kovů ve slitině, která byla připravena z 2,5 kg mědi, 500 g zlata a 20 000 mg stříbra. (w(Cu) = 0,828; w(Au) = 0,166; w(Ag) = 0,006)
- Jakou hmotnost hydroxidu sodného je třeba navážit pro přípravu 200 ml roztoku o molární koncentraci 0,2 mol . dm -3 . (m = 1,6 g NaOH)
- Jakou molární koncentraci bude mít roztok dusičnanu stříbrného, pokud jej připravíme z 2 g této soli a 90 ml vody. (c = 1,3 mol . dm -3 )
- Určete molární koncentraci roztoku dusičnanu stříbrného o w = 0,05 a ρ = 1,05 g . cm -3 . (c = 0,31 mol . dm -3 )
- Jaký je hmotnostní zlomek roztoku kyseliny chlorovodíkové o molární koncentraci c = 10 mol . dm -3 ? Hustota tohoto roztoku je 1,159 g . cm -3 (w = 0,31)
- Jak se změní hmotnostní zlomek roztoku, pokud z 300 g roztoku o hmotnostním zlomku w = 0,15 odpaříme 100 ml vody? (vzroste na w = 0,225)
- Jak se změní hmotnostní zlomek roztoku, pokud ke 200 g roztoku o w = 0,20 přilijeme 50 ml vody? (zmenší se na w = 0,16)
- Jak se změní molární koncentrace roztoku hydroxidu sodného o w = 0,10 a ρ = 1,12 g . cm -3 , pokud k 50 ml tohoto roztoku přilijete 100 ml vody. Objemovou kontrakci zanedbejte. (c = 0,093 mol . dm -3 )
4.2 Křížové schéma
