Křížové schéma
Dalším velmi častým způsobem přípravy roztoků je naředění koncentrovaného zásobního roztoku. Např. kyselina chlorovodíková se běžně prodává jako 35% vodný roztok, kyselina dusičná pak jako 65% roztok a kyselina sírová jako 98% roztok. Tyto zásobní roztoky si potom v laboratoři naředíte destilovanou vodou, jak budete potřebovat.
Dvě důležitá upozornění:
- Když ředíte koncentrovaný roztok kyseliny, tak vždy přidávejte tento roztok do většího množství vody. Jinak hrozí vyprsknutí, které by vás mohlo poleptat.
- Při zacházení s kyselinami vždy používejte chemické brýle nebo štít. Kdyby přesto došlo k poranění oka, vždy to oznamte svému učiteli. Ten ví, jak správně postupovat, a postará se o vás.
Jak tedy může taková příprava roztoku vypadat? Představte si, že potřebujeme připravit 1,5 litru roztoku kyseliny dusičné o hmotnostním zlomku 15 %. Hustota takového roztoku je ρ 15% = 1,084 g . cm -3 . K dispozici máme zásobní, koncentrovaný, roztok kyseliny dusičné o hmotnostním zlomku 65 %. Hustota zásobního roztoku je ρ 65% = 1,391 g . cm -3 .
Celý postup můžeme rozdělit do tří kroků:
1. Krok – zápis:
V příkladech na míchání roztoků je
velmi důležité se neztratit. Většinou mícháme dva roztoky a
připravujeme tak roztok třetí. Proto doporučuji si výchozí
roztoky indexovat čísly 1 a 2. Výsledný roztok pak indexujte
3. Pro náš příklad by zápis vypadal následovně.
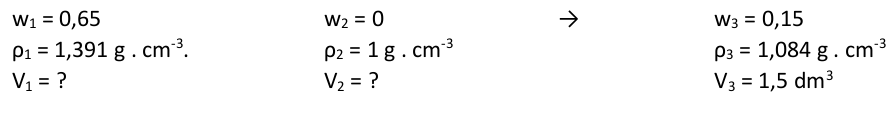
Kde jsme vzali hodnoty pro druhý roztok, když o něm v textu není ani zmínka? Druhý roztok totiž vůbec není roztok, ale je to čistá voda (pro hnidopichy chemicky čistá látka. Pro ještě větší hnidopichy, roztok ledasčeho, ale rozhodně ne kyseliny dusičné). Potřebujeme totiž koncentrovaný roztok jednoduše naředit, a když není uvedeno jinak, automaticky předpokládáme, že rozpouštědlem je voda. Abychom měli jednotný zápis, tak voda je 0% roztokem kyseliny dusičné, proto w 2 = 0. Pro hustotu vody automaticky předpokládejte hodnotu ρ 2 = 1 g . cm -3 . Jednak se s touto hodnotou dobře počítá, druhak chyba, které se tímto předpokladem dopustíme, je zanedbatelná.
2. Krok – sestavení kříže
Nyní si vytvoříme následující schéma.
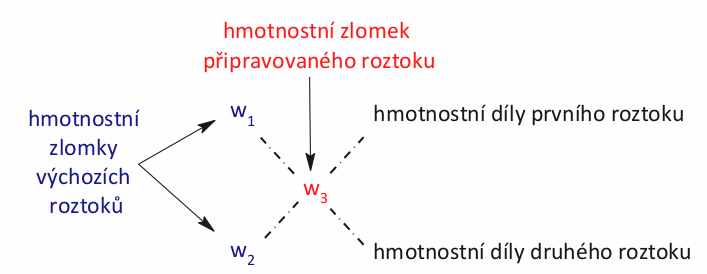
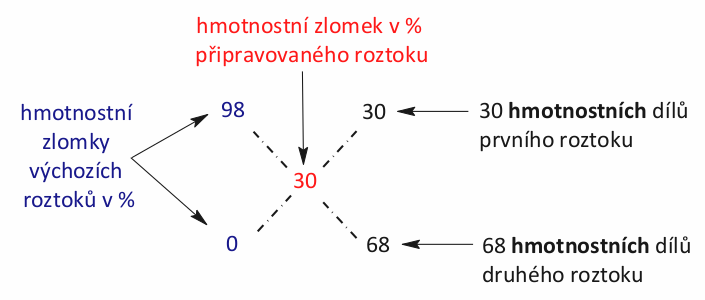
Pod sebe si napíšeme hmotnostní zlomky výchozích roztoků v procentech. Hmotnostní zlomek výsledného roztoku zapíšeme do středu pomyslného kříže. Poté po úhlopříčkách zlomky odečteme a výsledek zapíšeme. Odečítáme tak, aby výsledek byl vždy kladný. Náš příklad by vypadal následovně.
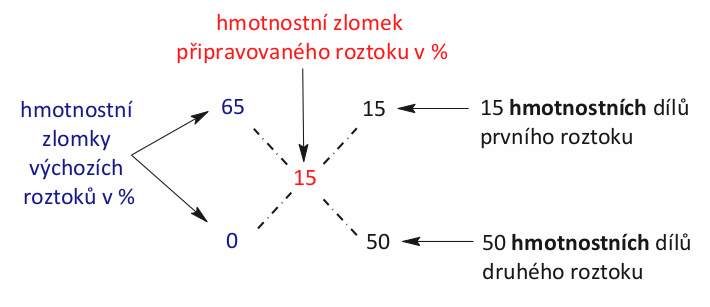
Důvod, proč se obvykle zapisují hmotnostní zlomky v %, je čistě estetický. Pokud byste je zapsali desetinným číslem, postup by se nijak nezměnil, jen hmotnostní díly by vám také vyšly jako desetinné číslo. To působí poněkud nepřirozeně. Použití procent zajistí, že vám hmotnostní díly vyjdou jako celá čísla.
3. Krok – vlastní výpočet
Křížovým schématem jsme zjistili, kolik hmotnostních dílů
prvního a druhého roztoku musíme smíchat. Co je ale ten
hmotnostní díl? Jakou hmotnost představuje? V tomto kroku se
příklady na mísení roztoků liší. Vždy máte ale udanou
hmotnost, připouštím, že někdy dosti skrytě, jednoho
z roztoků. V našem příkladu máme zadáno, že máme připravit
1,5 dm
3
roztoku o koncentraci 15 %. To je přeci objem. Máme však
údaj i o hustotě, přes kterou si hmotnost z objemu snadno
spočítáme. Jistě vás, už jako zkušené mazáky, nemusím
upozorňovat na to, že je rozumné do výpočetních vztahů
dosazovat v odpovídajících si jednotkách.
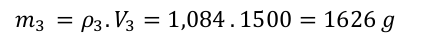
Spočítali jsme si, že potřebujeme připravit 1626 g roztoku. Výsledný roztok vzniká smísením obou roztoků. 15 hmotnostních dílů prvního roztoku a 50 hmotnostních dílů druhého roztoku. Hmotnost výsledného roztoku bude proto odpovídat 65 dílům.
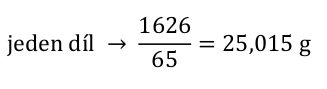
A výpočet se chýlí ke konci. Spočítáme hmotnosti jednotlivých roztoků a z nich pak určíme objemy a je hotovo.
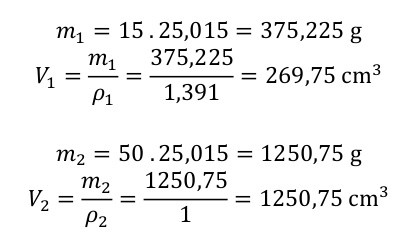
Pro přípravu 1,5 dm 3 15% roztoku kyseliny dusičné je třeba smísit 269,75 cm 3 65% roztoku této kyseliny a 1250,75 cm 3 vody.
Jiný příklad by mohl vypadat takto. Kolik mililitrů 30% kyseliny sírové je možné připravit z 50 ml jejího 98% roztoku? Hustota 30% roztoku kyseliny sírové je ρ 30% = 1,219 g . cm -3 . Hustota 98% roztoku kyseliny sírové je ρ 98% = 1,836 g . cm -3 .
Tentokrát postup projedeme rychleji a všimneme si zásadní odlišnosti od předešlého příkladu.
1. Krok – zápis:
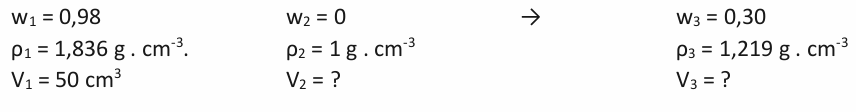 2. Krok – sestavení kříže
2. Krok – sestavení kříže
 3. Krok – vlastní výpočet
3. Krok – vlastní výpočet
Nyní musíme opět zjistit,
jaká hmotnost připadá na jeden hmotnostní díl. Zde právě
narazíme na odlišnost od předešlého příkladu. Zatímco
v předešlém příkladu jsme znali hmotnost výsledného roztoku,
zde známe – lépe řečeno umíme spočítat – hmotnost jednoho
z výchozích.
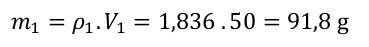
Protože na 98% kyselinu připadá 30 dílů, spočítáme jeden díl následovně.
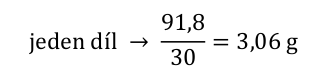
Na připravovanou 30% kyselinu připadá potom 98 dílů a její hmotnost a objem určíme snadno.
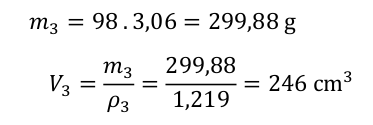
Z 50 ml 98% kyseliny sírové je možné připravit 246 ml roztoku 30% kyseliny sírové.
Příklady pro procvičení:
- Jak připravíte 60 g 10% roztoku kyseliny sírové, máte-li k dispozici 98% kyselinu sírovou o hustotě ρ 98% = 1,836 g . cm -3 ? (3,33 ml 98% kyseliny sírové a 53,9 ml vody)
- Jaké množství vody bude potřeba k naředění 150 g 60% kyseliny dusičné na 15% kyselinu dusičnou? (450 ml vody)
- Jak připravíte 90 g 10% roztoku kyseliny chlorovodíkové, máte-li k dispozici 35% kyselinu chlorovodíkovou o hustotě ρ 35% = 1,174 g . cm -3 ? (21,9 ml 35% kyseliny chlorovodíkové a 64,3 ml vody)
- V jakém objemu vody je třeba rozpustit 20 g hydroxidu draselného, aby vzniknul roztok o hmotnostním zlomku w(KOH) = 0,15? (113,3 ml vody)
- Tento příklad není příliš realistický, ale spočítáte jej hladce. Učíme se hlavně princip výpočtu. Jakou hmotnost 40% a jakou hmotnost 10% roztoku zlatité soli je třeba smíchat, abyste připravili 100 g 20% roztoku. (33,3 g 40% roztoku, 66,7 g 10% roztoku)
- Jakým způsobem byste připravili roztok zlatité soli z předešlého příkladu poněkud logičtěji? (Smícháním 50 g 40% roztoku zlatité soli a 50 ml vody)
- Kolik krystalického chloridu draselného je třeba přidat k 150 g jeho 5% roztoku, aby vznikl roztok 10%? (8,3 g KCl)
- Jak připravíte 200 g 15% roztoku kyseliny fosforečné, máte-li k dispozici 50% kyselinu fosforečnou o hustotě ρ 50% = 1,335 g . cm -3 ? (44,9 ml 50% kyseliny fosforečné a 140 ml vody)
4.3 Směšovací rovnice
