Teorie kyselin a zásad
Nejprve si pojďme vyjasnit, jaké látky budeme označovat jako kyseliny a jaké budeme nazývat báze. Jedna z prvních všeobecně uznávaných definic byla formulována švédským chemikem Svante Arrheniem, nositelem Nobelovy ceny za chemii z roku 1903.
Arrheniova definice kyseliny: Kyselina je látka, která ve vodném prostředí poskytuje kation vodíku H + .
Reakce molekuly kyseliny s molekulou vody, ve které kyselina předá vodíkový kation vodě, se nazývá disociace kyseliny . Výsledkem této reakce třebas pro kyselinu chlorovodíkovou jsou částice H 3 O + a Cl - .
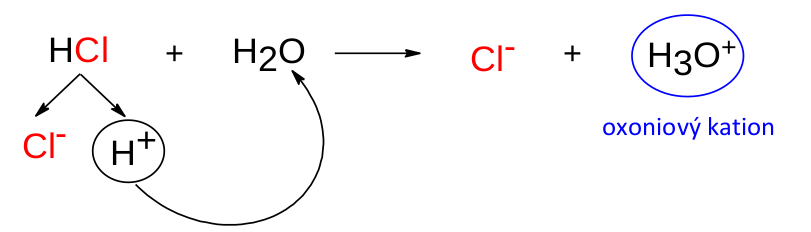
Právě částice H 3 O + nás bude nejvíce zajímat. Nazývá se oxoniový , někdy též hydroxoniový kation a je to právě ona, která činí kyseliny kyselé.
Vodíkový kation H + nemůže existovat samostatně. Jedná se v podstatě o proton, tedy velmi malou částici s velkým nábojem, která je neodolatelná pro volné elektronové páry kyslíku nebo třeba dusíku. Rychlost, kterou samostatný H + reaguje s molekulami vody, je neuvěřitelná a je jednou z nejvyšších vůbec.
Arrheniova definice zásady: Zásada je látka, která ve vodném prostředí poskytuje hydroxidový anion OH - .
Takový hydroxid sodný, typická zásaditá látka, se tedy ve vodném prostředí chová dle následující rovnice.
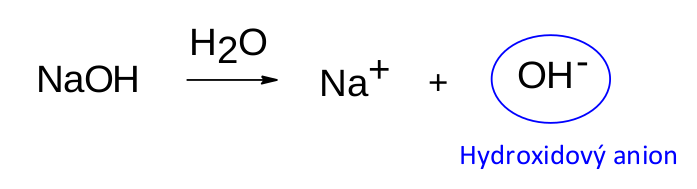
Reakcí vzniká hydroxidový anion OH - , který je zodpovědný za bazické chování. Všimněte si jednoho rozdílu mezi oběma reakcemi. Zatímco v případě kyselin je voda přímým účastníkem reakce kyselin, a proto je zapsána před šipku, v reakcích bází figuruje jako rozpouštědlo, a proto se píše nad šipku.
Svante Arrhenius kromě toho, že byl vynikajícím vědcem se skvělými výsledky, měl i stinnou stránku. Jakožto vážený člen švédské akademie věd neváhal použít svého vlivu na udělování Nobelových cen. Na nepřátelství s Arrheninem doplatil třeba sám věhlasný Mendělejev, jeden z autorů periodického zákona a periodické tabulky, který byť by si ji bezesporu zasloužil, nikdy Nobelovu cenu nedostal. Na druhou stranu Mendělejev také nebyl úplné neviňátko, ale o tom jindy.
Arrheniova teorie je snadná. Pokud molekula ve vodě odštěpuje vodíkové kationy, je to kyselina. Pokud molekula odštěpuje ve vodě hydroxidové aniony, je to báze. Jednoduché, prosté. Ale jistě vás napadne jedna velmi významná nevýhoda takovéto definice kyselin a zásad. Co když rozpouštědlem nebude voda, ale třeba ethanol nebo benzín? Dalším, a to možná ještě větším problémem Arrheniovy definice je, že existují látky, které vykazují bazické chování, ale jejich molekuly vůbec OH - neobsahují, takže jej těžko mohou uvolňovat. Takovou látkou je třeba roztok bazického plynu amoniaku. Amoniak má strukturu NH 3 , tak kde by se tam nějaké OH - vzalo? Z těchto důvodů byla Arrheniova teorie upravena dánským fyzikálním chemikem Brønstedem a britským chemikem Lowrym.
Brønsted - Lowryho definice kyseliny: Kyselina je látka, která poskytuje kation vodíku H + .
Jediné, čím se liší obě uvedené definice kyselin, je prostředí. Brønsted a Lowry nevyžadují vodné prostředí.
Brønsted - Lowryho definice zásady: Zásada je látka, která je schopná přijmout kation vodíku H + .
Definice zásady dle Brønsteda a Lowryho se od definice Arrheniovy značně odlišuje. Vyřešilo to problém s amoniakem?
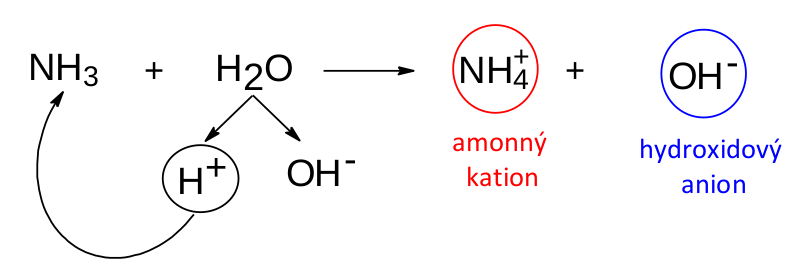
Jak je vidět z obrázku, problém je vskutku vyřešen. Amoniak se chová jako báze dle Brønsteda a Lowryho. Přijme vodíkový kation z molekuly vody a přeměnní se na amonný kation. Z molekuly vody zbyde hydroxidový anion, který je zodpovědný za bazické chování roztoku.
Ještě nám zbývá zmínit dva pojmy, a to konjugovaný pár a amfoterní látka .
Konjugovaný pár je dvojice částic, které se vzájemně liší o H + . Jedna částice je kyselinou, druhá zásadou.
Takové konjugované páry můžeme najít např. u disociace kyseliny dusičné, kde molekula kyseliny dusičné předá vodíkový kation molekule vody. Vznikne tak dusičnanový anion a oxoniový kation. Pokud se zamyslíme nad definicí konjugovaného páru, všimneme si, že částice K 1 /Z 1 i K 2 /Z 2 tuto definici splňují.
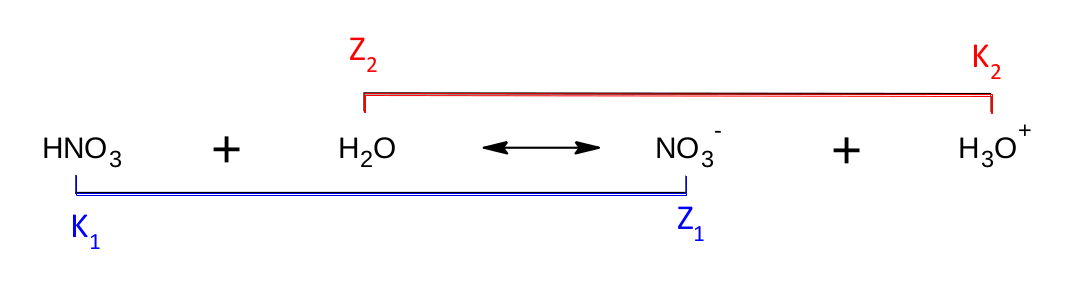
K 1 je bezpochyby kyselinou, však se tak i jmenuje. Z 1 je pak zásadou. Kyselinou být nemůže, nemá odštěpitelný vodík. Navíc pokud otočíme směr reakce, což naznačuje dvojitá šipka, přijímá Z 1 vodíkový kation, tedy je dle definice Brønsteda a Lowryho zásadou.
Zkusíme jiný příklad. Zkusíme najít konjugované páry v reakci kyseliny octové s amoniakem, která probíhá dle následující rovnice:
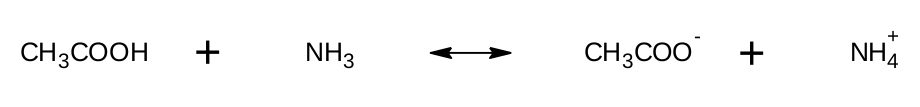
Z rovnice je zřejmé, že první molekula odštěpila vodíkový kation a stal se z ní anion, chová se tedy jako kyselina. Pokud by se reakce obrátila, musel by anion opět vodíkový kation přijmout a zachovat se tak jako zásada. Druhá molekula, amoniak, vodíkový kation přijala, zachovala se jako báze a stal se z ní amonný kation. Obráceně by se amonný kation zachoval jako kyselina. Doplněné schéma vypadá následovně:
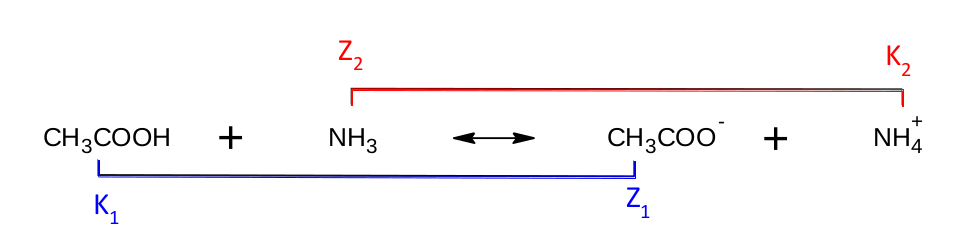
Pojem konjugovaný pár jsme si již osvojili a je na čase situaci trochu zkomplikovat. Zkusíme si napsat disociaci kyseliny sírové. Protože se jedná o dvojsytnou kyselinu – obsahuje dva odštěpitelné vodíky, může disociovat až do druhého stupně. Nejprve odštěpí jeden vodíkový kation, tedy disociuje do prvního stupně.
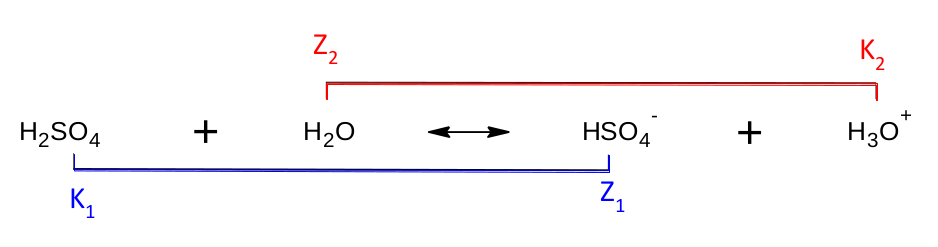
Vznikl nám tak hydrogensíranový anion HSO 4 - . Název této částice pro nás zatím není důležitý, ale všimněte si, že má stále jeden odštěpitelný vodíkový kation. Nebojme se toho a pojďme disociovat kyselinu sírovou do druhého stupně. Rovnice bude vypadat následovně:
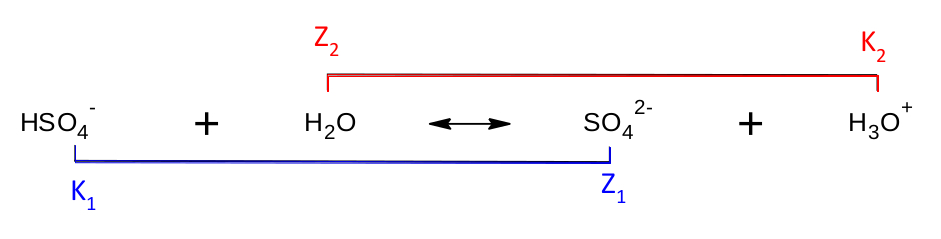
Pozorný čtenář si jistě všiml, že ona zvláštní částice HSO 4 - se v první rovnici chová jako zásada a ve druhé jako kyselina. A je tomu skutečně tak. Látky, které se dokáží chovat, jak kysele, tak i zásaditě, se nazývají amfoterní .
Na předponu amfo- či amfi- narazíte během svých studií ještě mnohokrát. Třeba třída obojživelníci se latinsky nazývá Amfibia .
Další z látek, která má amfoterní chování, je voda. Molekuly vody dokáží dokonce reagovat samy se sebou. Tato reakce se nazývá autoprotolýza vody a je základem pro odvození pH, tedy stupnice kyselosti, o které bude pojednávat jedna z následujících kapitol.

Otázka k zamyšlení 1: Navrhněte experiment, kterým byste jednoznačně dokázali, že i v nejčistší vodě probíhá autoprotolýza?
Další kapitola:3.2 Klasifikace kyselin a zásad
