Redukční pochody – výroba kovů
S redoxními pochody je neodmyslitelně spojena výroba kovů. Kovů se na světě využívá neuvěřitelné množství. Stačí se podívat kolem sebe. Je jich takové množství, že nemá cenu, abych tady vyjmenovával nějaké příklady, ale vy si to zkuste. Zkuste vymyslet využití následujících kovů: Li, Al, Ti, Fe, Cu, Zn, Sn, Au, Pt, U a Pb.
Jistě, pokud máte štěstí, nějaké kovy můžete najít ryzí. Některé meteority jsou prakticky čisté surové železo. Starověkými a středověkými dějinami hýbalo zlato a stříbro. Moc českých králů upevňovaly bohaté stříbrné doly u Kutné Hory. Neméně významné byly doly u Jáchymova, které patřily mocnému českému šlechtickému rodu Šliků. Kvalitní mince s maximálním množstvím stříbra, tzv. Šlikovský či Jáchymovský tolar, byly hojně vyváženy do zahraničí a staly se předchůdcem nynějšího amerického dolaru, kterému také propůjčili svůj název. Jáchymov, město, které v současnosti nemá ani tři tisíce obyvatel, ovlivnilo světové dějiny ještě jednou. V uranové rudě, tzv. jáchymovském smolinci, objevila Marie Curie-Skłodowská společně se svým manželem Pierrem Curie nový prvek, který nazvali radium. Za tento objev dostali v roce 1903 Nobelovu cenu za fyziku. Byla to první Nobelova cena udělena ženě vůbec. V roce 1911 tento svůj fenomenální úspěch, již bez manžela, který byl přejet drožkou, zopakovala, tentokrát v oboru chemie.
Mnohem pravděpodobnější však bude, že najdeme v přírodě rudu nějakého kovu. Rudy kovu jsou různé, typicky obsahují kov v podobě kationu a často propůjčují materiálům nějakou barvu. Z chemického hlediska to bývají oxidy, hydroxidy či nějaké soli. Nejznámější rudy jsou pravděpodobně rudy železa. Známe krevel (hematit), což je oxid železitý. Hnědel (to je opravdu název toto, limonit) je pak směsí oxidů a hydroxidů železa. Ocelek (siderit) je uhličitan železnatý. Pokud budete mít čas, náladu a peníze, zajeďte se podívat do jihofrancouzského Roussillon, abyste viděli, co příroda s kationy železa umí.

Roussillon leží v oblasti s obrovskými ložisky okru. Není to nádhera?
Získat čistý kov z rudy kovu lze v zásadě třemi způsoby:
Najděte si na internetu, jak vypadá oxid rtuťnatý, a když už v tom budete, tak si něco přečtěte i o rtuti. Je to velmi zajímavý kov.
Otázka k zamyšlení 10: Kočičí zlato, mineralogicky pyrit, chemicky disulfid železa FeS2si můžete při lehkém pomatení smyslů poplést se skutečným zlatem. Navrhněte alespoň tři chemické/vědecké způsoby, jakými byste kočičí zlato a reálné zlato odlišili.
Pokud je kov ve své rudě v oxidované podobě, v podobě kationu, není nic jednoduššího než ho zredukovat. Jelikož se kovy vyrábí ve velkém, musíme mít na paměti i ekonomickou stránku věci.
Wolfram se například získává redukcí své rudy, oxidu wolframového, vodíkem
Wolfram má nejvyšší teplotu tání ze všech kovů (z prvků je druhý, po uhlíku) a velmi vysokou hustotu. Tyto vlastnosti jej předurčily jednak jako výborný materiál pro vlákna klasických žárovek, druhak do různých projektilů protipancéřových střel. Tento prvek byl/je tak významný pro zbrojařský průmysl, že Portugalsko, významný producent wolframu, si udrželo za druhé světové války neutralitu až do roku 1944 a čile obchodovalo s oběma válčícími stranami.
Další velmi populární reakce je aluminotermie. Jedná se o klasický redoxní proces, který využívá velké ochoty hliníku reagovat s kyslíkem. V nejklasičtějším uspořádání reaguje oxid železitý a práškový hliník. Při této reakci se uvolňuje velké množství tepla. Dříve se proto používala ke svařování, nyní se tato směs používá v pyrotechnice. Pakliže si koupíte termit, malý dělbuch, tak jste si koupili aluminotermickou směs a je třeba být opravdu opatrný.
Aluminotermie by nebyla pro velkovýrobu železa příliš vhodná. Ve větším množství by se jednalo o extrémně nebezpečný a velmi drahý proces. Surové železo se průmyslově získává ve vysokých pecích . Název odpovídá charakteru zařízení, které je přes 30 metrů vysoké, a vnitřní teplota dosahuje v některých částech i 2000 °C. Do vysoké pece, která je schematicky znázorněna na obrázku, je třeba dodat tři základní složky. První složkou je logicky železná ruda . Druhou složkou je levné redukční činidlo, a to koks (chemicky je jedná o uhlík). Třetí složkou je vápenec (uhličitan vápenatý), který jednak upravuje pH taveniny uvnitř pece a chrání tak vnitřní vrstvu pece, a také je tzv. struskotvornou přísadou. Na uhličitan vápenatý a produkty jeho termického rozpadu se totiž nabalují různé nečistoty a vzniká materiál, struska , který je z pece odváděný pryč, aby neznečišťoval vzniklé železo. Samotný proces je celkem alchymie. Teplota uvnitř pece je ohromná a znemožňuje přesné zkoumání procesů. Nicméně staletým vývojem se proces výroby železa metodou pokus/omyl velmi zdokonalil a současná věda umožnila dostačující popis jednotlivých procesů.
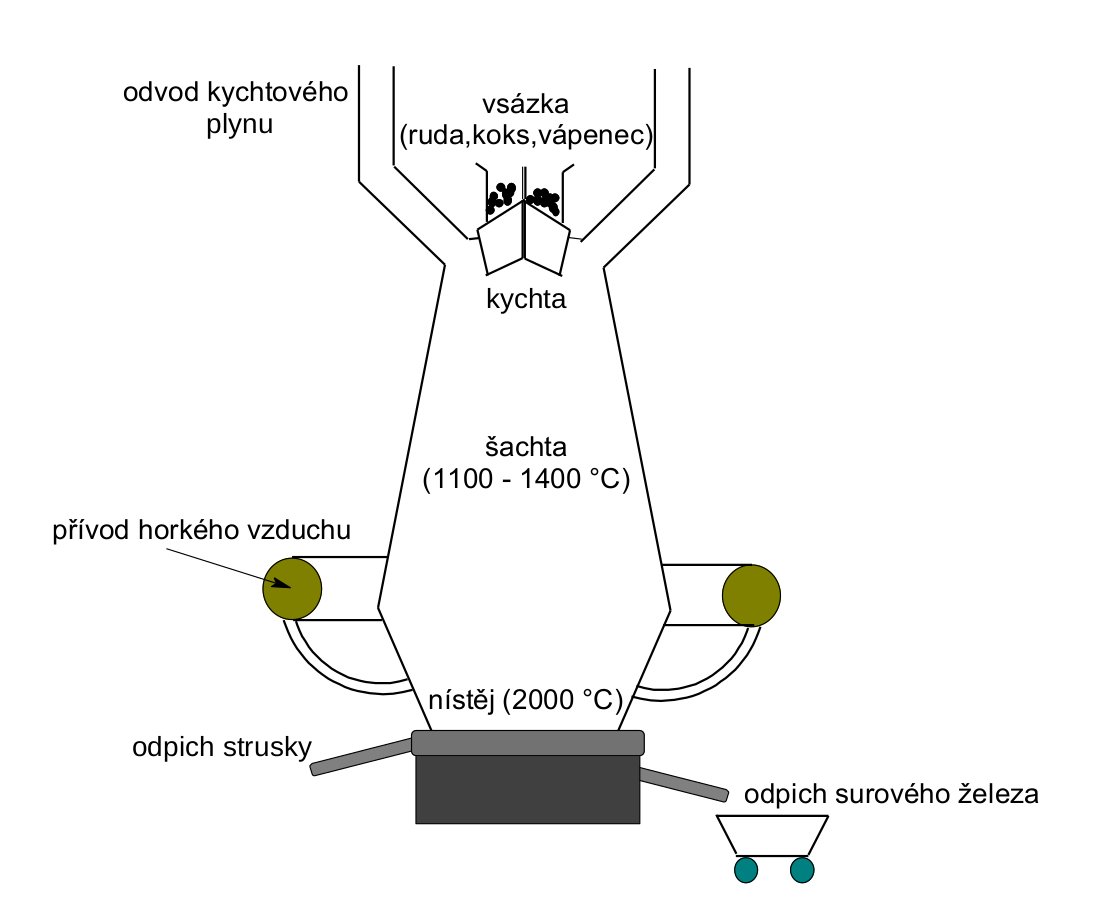
Schématický nákres vysoké pece.
V horní části pece probíhá předehřívání vsázky (ruda, koks, vápenec) a zároveň se z ní vypařuje voda. Postupným klesáním materiálu dochází v nižší části pece ke kontaktu rudy se spalinami, které obsahují i oxid uhelnatý s redukčními účinky. Zde začíná první redukční pochod.
Tavenina klesá dál pecí do zóny, kde se teploty pohybují mezi 1000 až 2000 °C. Zde dochází k dalším redukcím železa již přímo uhlíkem či oxidem uhelnatým.
Rozhodně není nutné se předcházející rovnice učit nazpaměť. Stačí jen pochopit princip, že se jedná o redukci železa uhlíkem či oxidem uhelnatým a snadno si jakoukoliv odvodíte.
Za povšimnutí stojí sloučenina Fe3O4, oxid železnato-železitý. V tomto oxidu je dvakrát Fe+IIIa jednou Fe+II. Znáte i jinou sloučeninu tohoto typu?
Spodní část vysoké pece se nazývá nístěj a odsud je horké surové železo odvezeno ve vozíčku nazývaném veronika na místo dalšího zpracování. Nebo se vylévá do jednotlivých kusů zvaných housky. Jiným otvorem z pece je odváděna struska a i ta se dále zpracovává. Surové železo obsahuje vysoké procento uhlíku. Snížením obsahu uhlíku a přimícháním různých jiných prvků (Mn, Ni, Cr, Al, Si) se získávají v ocelárnách různé typy ocelí. Vyšší procento uhlíku si ponechávají litiny.
Odpověď 10: Tak předně je pravé zlato kov, proto by se dala ověřit jeho kujnost či elektrická vodivost. Dále samozřejmě můžeme změřit hustotu a porovnat ji s tabelovanou hodnotou pro zlato. Jako chemická cesta se nabízí reakce s kyselinou chlorovodíkovou. Silná kyselina chlorovodíková by sulfid přeměnila na sulfan, který by byl velmi intenzivně cítit. Zapáchají po něm zkažená vajíčka. Jiná smradlavá cesta je pyrit upražit. Touto reakcí vzniká velmi dráždivý oxid siřičitý. Pravé zlato upražit nejde.
OBR
Pyrit ze školních sbírek.
Další kapitola:7.6 Elektrochemické články
