Klasifikace kyselin a zásad
Kyselin i zásad existuje nepřeberné množství, a proto je nanejvýš praktické je trošku rozškatulkovat. První praktické kritérium, které vás asi napadne, je jejich síla. Kdybyste dostali na výběr, zda budete politi kyselinou sírovou nebo kyselinou octovou, asi byste si ve snaze zachránit svoji tělesnou schránku vybrali kyselinu octovou. A dobře byste udělali. Jak ale poznat, která kyselina je silná? A co to vlastně znamená?

Na obrázku vidíte, co se stane, když běžný cukr potrápíte koncentrovanou kyselinou sírovou. Tato kyselina má silné dehydratační účinky. To znamená, že má tendenci „vytahovat vodu“. Cukr je organická látka, která se skládá z uhlíků, vodíků a kyslíků. Proto, když na něj necháme působit kyselinu sírovou, zčerná. To je zbylý uhlík, který se navíc našlehá uvolňující se vodní parou a parami kyseliny sírové. Koncentrovaná kyselina sírová je velmi nebezpečná látka.
Z toho důvodu také platí, že když ředíte kyseliny vodou, tak vždy přidáváte kyselinu do většího množství vody. V opačném případě, přídavku vody do většího množství kyseliny, by se mohlo uvolnit tolik tepla, že by voda začala vřít a prskat, podobně jak to dělá na pánvi s olejem. Poté by velmi snadno mohlo dojít k poleptání či nešťastnému zasažení oka. Vždy noste v laboratoři brýle!
Jak už jsme si řekli, kyseliny jsou látky, které odštěpují H + . Čím snáze bude kyselina H + odštěpovat, tím bude silnější. V základním rozdělení se kyseliny dělí na silné a slabé . Silné kyseliny jsou v roztoku zcela disociovány. To znamená, že každá molekula silné kyseliny poskytne svůj vodíkový kation vodě. V roztoku tedy nebude přítomna nerozdisociovaná forma kyseliny. Na obrázku vidíte příklad roztoku silné kyseliny dusičné.
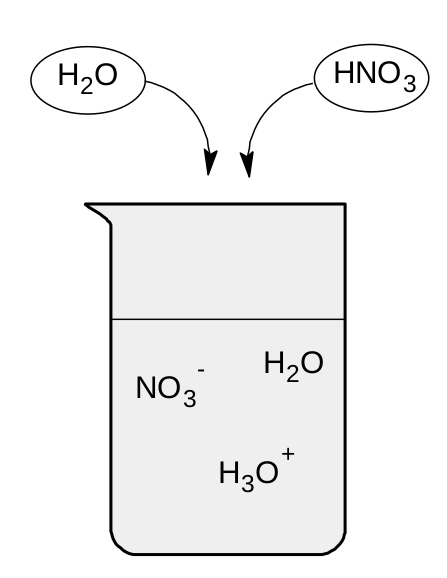
Protože se jedná o silnou kyselinu, všechny její molekuly předají vodíkové kationy vodě za vzniku oxoniových iontů. V roztoku tedy nebude částice HNO 3 .
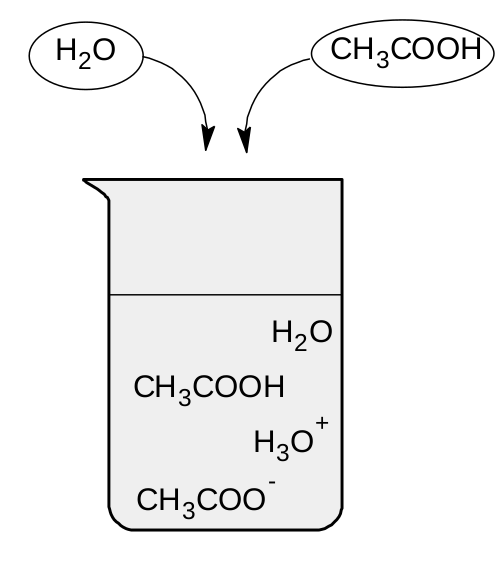
Slabé kyseliny se disociují jen částečně. To znamená, že některé molekuly odevzdají své vodíkové kationy, ale jiné si je nechají. Proto když připravíme roztok z kyseliny octové, najdeme v něm jak nerozdisociované molekuly kyseliny CH 3 COOH, tak produkty disociace CH 3 COO - a H 3 O + .
Odpověď 1: Experiment by mohl vypadat velmi jednoduše. Stačí dokázat, že i nejčistší forma vody, vede elektrický proud. Pokud by autoprotolýza neprobíhala, voda by byla tvořena pouze elektroneutrálními molekulami a nevedla by elektrický proud.
Se zásadami to bude analogicky. Čím je zásada silnější, tím více bude přijímat vodíkové kationy. Všechny molekuly silných zásad přijmou vodíkový kation a říkáme o nich, že jsou protonizovány. U slabých zásad jsou v roztoku jen některé molekuly protonizovány, jiné zůstávají v původní podobě.
Tak které jsou silné a které slabé? U bezkyslíkatých kyselin si to zjednodušíme. Pro jejich sílu platí následující sekvence:
HF ˂ HCl ˂ HBr ˂ HI
Kyselina fluorovodíková je slabá, ostatní jsou silné. Vysvětlení je poměrně snadné. Vazba H-F je iontová, a proto velmi pevná. Fluor se tedy vodíku nerad zbavuje. Postupně ve skupině iontovost vazby klesá, a proto prvky snáze odštěpují vodíkový kation a jejich síla tak roste.
Důležitá poznámka. Že je kyselina slabá vůbec neznamená, že není nebezpečná. Síla kyselin je dána pouze ochotou poskytovat kation vodíku, ale to je jen část příběhu. Např. slabá kyselina fluorovodíková kromě toho, že výborně rozkládá tkáně či leptá oči (zejména kvůli fluoridovému anionu F - ), je také vysoce toxická a způsobuje třeba otok plic. A obráceně, některé z nejsilnějších dosud připravených kyselin, třeba kyseliny na bázi karboranu (sloučeniny uhlíku a bóru), jsou takřka neškodné.
U kyslíkatých kyselin to bude krapet složitější. Pomůžeme si jednoduchým schématem. Pokud bude kyselina splňovat formální vzorec
Určete sílu následujících kyselin (ano, jsou zadané slovy:-)). Řešení naleznete na následující stránce.
kyselina křemičitá
kyselina manganistá
kyselina chlorovodíková
kyselina dusičná
kyselina chlorečná
kyselina fluorovodíková
Řešení popořadě: slabá, velmi silná, silná, silná, silná, slabá
Další významné kritérium pro dělení kyselin je jejich sytnost . Je to velmi jednoduché. Pokud je kyselina jednosytná, má pouze jeden odštěpitelný vodík a může tedy disociovat pouze do prvního stupně. Odštěpitelné vodíky poznáte v molekulách kyselin snadno, jsou totiž k centrálnímu atomu připojeny přes kyslík. Jednosytná kyselina je třeba kyselina dusitá.
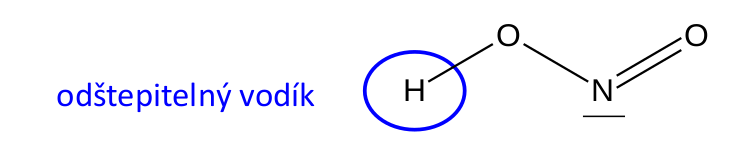
Jednosytná kyselina dusitá.
Vícesytné kyseliny mají více odštěpitelných vodíků. Jako příklady nám poslouží dvojsytná kyselina siřičitá nebo trojsytná kyselina fosforečná.

Dvojsytná kyselina siřičitá a trojsytná kyselina fosforečná.
Občas je to ale záludné. Existuje např. kyselina se vzorcem H 3 PO 3 , kterou bychom s lehkou myslí považovali za trojsytnou kyselinu a pojmenovali ji kyselina trihydrogenfosforitá. Její stabilnější forma má však strukturu zobrazenou níže a je tedy kyselinou dvojsytnou. Pro milovníky názvosloví, správný název by byl kyselina fosfonová.
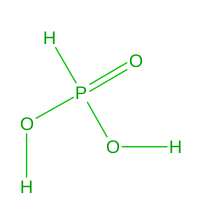
Kyselina fosfonová.
Další kapitola:3.3 Teorie pH
