Teorie pH
S kyselinami a zásadami už jsme se poprali a nyní je čas se seznámit s pH. Půjdeme na to přes vodu. Již jsme se naučili, že voda má amfoterní charakter. V reakci, které se říká autoprotolýza vody, se tato vlastnost vody projeví naplno. Jedna molekula vody se zachová jako kyselina a naprotonizuje druhou molekulu vody, která se tedy zachová jako zásada.
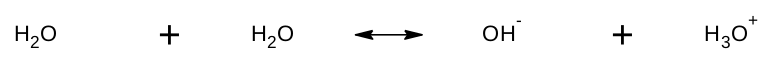
Tato reakce probíhá ve velmi malé míře. Pro představu ve Slapské přehradě, ve které je 269 300 000 tun vody, se nachází pouze 512 kg částic H 3 O + a 458 kg částic OH - . To je méně než jeden krychlový metr. Bylo změřeno, že pro čistou vodu o teplotě 25 °C jsou molární koncentrace oxoniových a hydroxidových iontů rovny c(H 3 O + ) = c(OH - ) = 1 . 10 -7 mol . dm -3 . Roztok, který obsahuje stejný počet H 3 O + a OH - iontů, označujeme jako neutrální .
Otázka k zamyšlení 2: Je běžná voda skutečně pH neutrální látka?
To bychom měli čistou vodu. Počet oxoniových a hydroxidových iontů v roztoku můžeme však velmi snadno změnit. Pokud do roztoku přidáme nějakou kyselinu, její molekuly se rozdisociují a vytvoří s neutrálními molekulami vody nové H 3 O + . Roztok kyseliny tedy bude obsahovat více H 3 O + než OH - iontů. Takový roztok logicky označujeme jako kyselý . Obráceně to funguje také. Pokud přidáme do roztoku zásadu, vzniknou nové OH - ionty. Roztok, který má více OH - v porovnání s H 3 O + se nazývá zásaditý nebo bazický .
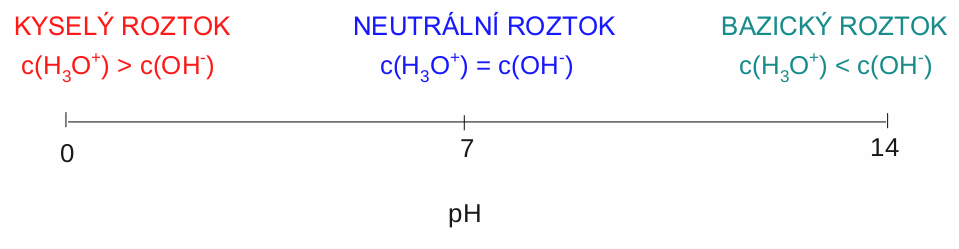
Míru kyselosti či zásaditosti roztoku nám vyjadřujestupnice pH. Je to stupnice, nevylekejte se, logaritmická. S logaritmy se seznámíte podrobně na hodinách matematiky ve vyšším ročníku. Nyní si jen uživatelsky vysvětlíme, co to je. Už jsme si vysvětlili, že kyselost/zásaditost roztoku nám určuje množství, přesněji poměr množství, iontů H 3 O + a OH - . V čisté vodě jsou molární koncentrace zmíněných iontů shodné a to c(H 3 O + ) = c(OH - ) = 1 . 10 -7 mol . dm -3 . Číslo 1 . 10 -7 neboli 0,0000001 je pro výpočty neuvěřitelně nepraktické, a právě tady nastupují logaritmy. Logaritmus je funkce, matematikáři odpustí, která z velmi velkých nebo velmi malých čísel umí udělat číslo mnohem hezčí a praktičtější.
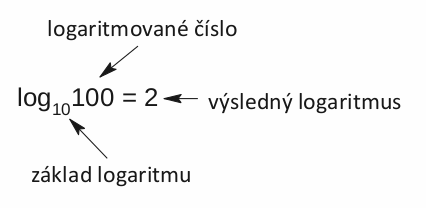
Rozepíšeme si to slovy. Například logaritmus se základem deset (tzv. dekadický logaritmus) čísla sto je roven dvěma, protože deset na druhou je sto. Logaritmus nějakého čísla je tedy číslo, kterým když umocníme základ logaritmu, získáme původní logaritmované číslo.
Další příklady:
log 10 1 000 000 = log 10 10 6 = 6
log 10 0,001 = log 10 10 -3 = -3
Zlogaritmovat můžeme i méně hezká čísla, ale na to již budeme potřebovat kalkulačku. Najdi si tu svoji a zkus spočítat následující příklady. Nejprve zmáčkneš tlačítko log, poté zadáš logaritmované číslo a dáš zobrazit výsledek.
log 10 35 = 1,544
log 10 200 = 2,301
log 10 0,016 = -1,796
Zpátky k chemii. Co se stane, když zlogaritmujeme hodnotu c(H 3 O + ) v čisté vodě?
log 10 c(H 3 O + ) = ?
log 10 10 -7 = -7
Tedy jsme z celkem nepraktického čísla 1. 10 -7 logaritmováním udělali mnohem líbivější -7. Nyní celou rovnici vynásobíme -1.
(-1) . log 10 10 -7 = (-1) . (-7)
-log 10 10 -7 = 7
A máme krásnou kladnou sedmičku. Matematicky jsme udělali záporný dekadický logaritmus koncentrace oxoniových iontů . Aby to studenty neděsilo, tak se to zkracuje na pH. Malé p je zkratka pro záporný dekadický logaritmus, H je pak zkratka pro molární koncentraci H 3 O + iontů.
Definice pH: pH = - log 10 c(H 3 O + )
Čistá voda má hodnotu pH = 7. Kyselý roztok obsahuje více H 3 O + iontů, a proto jeho pH bude nižší než 7. Možná vám to přijde nelogické. Více H 3 O + a přesto menší hodnota pH. Je to proto, že ve výpočtu máme to mínusko. V klidu si to rozmyslete.
Pokud bychom měli v roztoku kyseliny koncentraci c(H 3 O + ) = 1 . 10 -5 mol . dm -3 , která je dokonce o dva řády vyšší než v čisté vodě, a spočítali bychom pH takového roztoku, získali bychom hodnotu pH = 5. Vyzkoušejte si to.
Zásaditý roztok bude mít hodnotu vyšší než 7. Horní hranici pH stupnice tvoří hodnota 14. Proč je to zrovna 14, je na vysvětlení trochu složitější a budete si na něj muset pár let počkat. Nyní vám nezbývá než mi věřit.
Ukázkové příklady na výpočet pH roztoku kyseliny:
Nejprve jednoduchý. Spočítejte pH roztoku kyseliny dusičné o koncentraci c(HNO 3 ) = 0,03 mol . dm -3 .
Kyselina dusičná je silná, a proto v roztoku zcela disociuje. Všechny její molekuly odštěpí vodíkové kationy a vytvoří H 3 O + , proto můžeme říci, že koncentrace HNO 3 a H 3 O + budou shodné. Hodnotu pH pak spočítáme snadno dle definice.
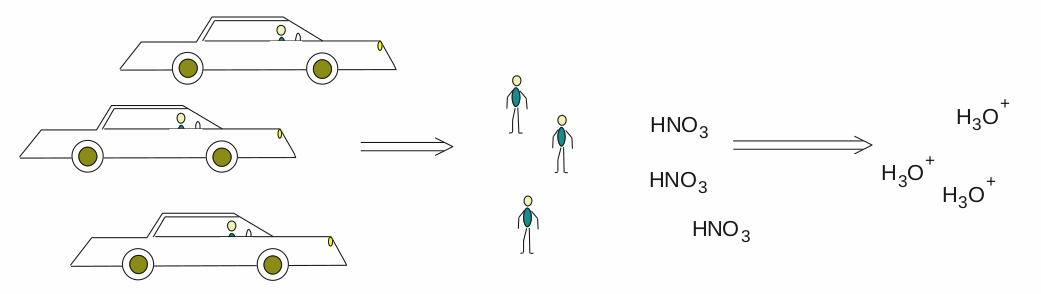
Pokud vám tento myšlenkový postup není jasný, zkusme si to vysvětlit na příkladu s auty na obrázku. Máme informaci, že na parkovišti stojí 150 aut (v jednom litru roztoku máme 0,03 mol HNO 3 ). Na základě této informace můžeme bezpečně prohlásit, že se okolo parkoviště potuluje 150 řidičů, protože na každé auto připadá právě jeden řidič (na jednu molekulu HNO 3 připadá právě jeden kyselý vodík).
Samozřejmě, že tento názorný příklad bude platit, pokud každé auto přiveze právě jednoho člověka, a to svého řidiče. Byť je to lákavé, nerýpejte do něj.
Rovnice popsaného děje vypadá následovně:
HNO 3 + H 2 O → NO 3 - + H 3 O +
c(HNO 3 ) = c(H 3 O + ) = 0,03 mol . dm -3
pH = - log(H 3 O + ) = 1,52
Hodnota pH roztoku kyseliny dusičné o molární koncentraci c(HNO 3 ) = 0,03 mol . dm -3 je pH = 1,52.
Trochu složitější příklad. Spočítejte pH roztoku kyseliny sírové o koncentraci c(H 2 SO 4 ) = 0,01 mol . dm -3 .
Kyselina sírová je silná, a proto v roztoku zcela disociuje. Všechny její molekuly odštěpí dva vodíkové kationy, které vytvoří H 3 O + . Tady nastává ta komplikace. Protože se jedná o kyselinu dvojsytnou, koncentrace H 3 O + bude dvojnásobná oproti koncentraci kyseliny.
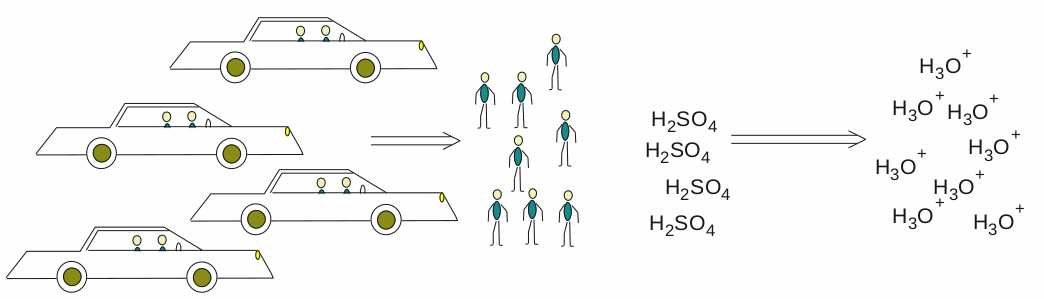
Pokud nerozumíte, představíme si opět obdobnou situaci s auty. Představme si, že na parkoviště přijela čtyři auta a víme, že v každém seděli dva lidé. V našem příkladu víme, že v litru roztoku máme 0,01 molu kyseliny sírové a každá molekula kyseliny obsahuje dva kyselé vodíky. Když se nás někdo zeptá, kolik lidí vlastně přijelo. Není nic snazšího, počet aut krát dva, přijelo osm lidí. Ta samá otázka na naši kyselinu zní, kolik uvolnila kationů vodíku. Řešení je stejné, množství kyseliny krát dva. Chemická rovnice, která tento děj vyjadřuje, vypadá následovně:
H 2 SO 4 + 2 H 2 O → SO 4 2- + 2 H 3 O +
Poměr je hezky vidět i z rovnice. Před kyselinou je jednička, která se nepíše, a před částicemi H 3 O + je dvojka. Poměr kyseliny a oxoniových iontů je 1 : 2.
2. c(H 2 SO 4 ) = c(H 3 O + ) = 2 . 0,01 = 0,02 mol . dm -3
pH = - log(H 3 O + ) = 1,70
Jak ale spočítáme pH roztoku hydroxidu? Třeba hydroxidu sodného o molární koncentraci c(NaOH) = 0,01 mol . dm -3 . Již víme, že se molekuly hydroxidu sodného ve vodě rozdělí na sodné kationy Na + a hydroxidové aniony OH - . Protože každá molekula hydroxidu sodného obsahuje právě jeden hydroxidový anion, můžeme říci, že koncentrace hydroxidových anionů je shodná s koncentrací hydroxidu sodného, tedy c(OH - ) = 0,01 mol . dm -3 . Známe koncentraci OH- iontů. Ale co s ní? Stejně jako jsme zavedli pH, existuje i pOH. Myšlenka je úplně stejná. Uděláme záporný dekadický logaritmus ale tentokrát z koncentrace OH - iontů.
Definice pOH: pOH = - log 10 c(OH - )Dále platí pH + pOH = 14
Pokud známe hodnotu pOH roztoku, jeho pH spočítáme snadno. Odečteme pOH od 14 a je to.
Ukázkové příklady na výpočet pH roztoku hydroxidu:
Pojďme spočítat pH roztoku hydroxidu draselného o koncentraci c(KOH) = 0,03 mol . dm -3 . Pokud počítáme pH roztoku hydroxidu, neumíme rovnou určit koncentraci H 3 O + iontů. Musíme to obejít přes pOH. Hydroxid draselný se ve vodě rozdisociuje, a protože molekula KOH obsahuje právě jeden OH - ion, můžeme zapsat, že koncentrace KOH a OH - jsou shodné. Poté spočítáme pOH, odečtem od 14 a získáme pH.
KOH → K + + OH -
c(KOH) = c(OH - ) = 0,03 mol . dm -3
pOH = - log(OH - ) = 1,52
pH = 14 - pOH = 14 – 1,52 = 12,48
Složitější příklad s hydroxidem. Spočítejte pH roztoku hydroxidu barnatého o koncentraci c(Ba(OH) 2 ) = 0,022 mol . dm -3 . Stejně jako v případě dvojsytných kyselin a oxoniových kationů, i zde bude platit, že z jedné molekuly hydroxidu vzniknou dva hydroxidové aniony. Spočítáme tedy koncentraci hydroxidových iontů, pak pOH a závěrem pH.
Ba(OH) 2 → Ba 2+ + 2 OH -
2 . c(Ba(OH) 2 ) = c(OH - ) = 0,044 mol . dm -3
pOH = - log(OH - ) = 1,36
pH = 14 - pOH = 14 – 1,36 = 12,64
Odpověď 2: Otázka je to jednoduchá, ale odpověď tak snadná nebude. Předně voda jako chemicky čistá látka musí obsahovat pouze molekuly vody. Žádné rozpuštěné soli, žádné organické látky, jen molekuly vody. Takovou vodu bychom při troše štěstí našli v podobě ledu v některých odlehlých oblastech. Pokud bychom led ale rozpustili, došlo by k rozpuštění plynů přítomných ve vzduchu. Dusík ani kyslík pH vody příliš neovlivní, ale třeba oxid uhličitý ano. Tento plyn je kyselý a pH tedy snižuje. Závěrem můžeme říci, že voda, se kterou se běžně setkáváte, přesně neutrální velmi pravděpodobně nebude.
Příklady na procvičení:
Vždy se dopředu zamyslete nad přibližnou hodnotou výsledku. Zamezíte tak zbytečným chybám. Roztok kyseliny musí mít pH pod 7, roztok hydroxidu nad 7.
- Určete pH roztoku kyseliny chloristé o molární koncentraci c = 0,002 mol . dm -3 . (pH = 2,70)
- Určete pH roztoku kyseliny sírové o molární koncentraci c = 0,002 mol . dm -3 . (pH = 2,40)
- Určete pH roztoku hydroxidu lithného o molární koncentraci c = 0,015 mol . dm -3 (pH = 12,18)
- Určete pH roztoku hydroxidu vápenatého o molární koncentraci c = 0,015 mol . dm -3 (pH = 12,48)
- Jaké pH má roztok připravený z 250 ml roztoku kyseliny sírové o molární koncentraci 0,1 mol . dm -3 a 500 ml vody. Objemovou kontrakci zanedbejte. (pH = 1,18)
- Z 8 g čistého hydroxidu draselného bylo připraveno 3,5 dm 3 vodného roztoku. Jaké pH měl tento roztok? (pH = 12,61)
Asi je jasné, že pouhým pohledem na neznámý roztok se nedá pH zjistit. Pokud roztok připravujeme ze zásobních roztoků o známé koncentraci, můžeme pH spočítat. V jiném případě musíme pH změřit. V laboratoři nám bude velmi často stačit pouze přibližná znalost hodnoty pH. K tomuto účelu se používají pH indikátorové papírky . Tyto papírky jsou napuštěné látkami, kterým se říká acidobazické indikátory . Tyto látky mají úžasnou vlastnost, mění svoji barvu na základě pH okolí. Jedním z nejpoužívanějších acidobazických indikátorů je fenolftalein . Tato látka je v kyselém prostředí bezbarvá, v zásaditém je sytě růžová. Tabulka uvádí nejpoužívanější acidobazické indikátory včetně jejich barev v kyselém a zásaditém prostředí.
Nejběžnější acidobazické indikátory.
|
methyloranž |
oranžová |
žlutá |
|
methylčerveň |
červená |
žlutá |
|
lakmus |
červená |
modrá |
|
bromthymolová modř |
žlutá |
modrá |
|
fenolftalein |
bez barvy |
fialová |
Použití indikátorových papírků je velmi snadné. Skleněnou tyčinkou přenesete kapku měřeného roztoku na indikátorový papírek. Ten změní barvu. Barvu následně porovnáte se škálou barev, která je na tubě od papírků a je hotovo.

Postup měření pH pomocí indikátorového papírku.
V některých případech je nutné změřit hodnotu pH přesně. K tomuto účelu se používá pH metr . To je úžasný a v dnešní době již velmi malý přístroj, který se obvykle skládá z krabičky a pH sondy. Právě sonda je ono měřící zařízení. Její stěna je vyrobena ze zvláštního a velmi tenkého skla. Sklo je tak tenké, že umožňuje měřícímu systému (pro skalní fyziky: měřenou hodnotou je napětí) porovnat složení vnějšího prostředí (tedy náš měřený roztok) a vnitřního prostředí (roztok o neměnném složení uvnitř pH sondy). Na základě tohoto rozdílu krabička dokáže spočítat hodnotu pH.
Další kapitola:3.4 Acidobazické titrace
