Anorganické názvosloví
V následující kapitole se naučíme pojmenovávat anorganické látky. Máme velké štěstí, protože vynikající čeští chemici Alexander Sommer Batěk a Emil Votoček vytvořili unikátní systém, který nám mohou všude v zahraničí závidět. Čeština totiž je jazyk tak bohatý, že dokáže vytvořit osm malebných koncovek, na kterých je názvosloví postaveno a které nám velmi usnadní práci. O takovém počtu si angličtina, němčina či francouzština mohou nechat jen zdát.
Nejprve je nezbytné se seznámit s pojmem oxidační číslo .
Definice: Oxidační číslo je rovno náboji, který by atom získal při úplné polarizaci svých vazeb v molekule či iontu.
Definice je to trochu krkolomná, a proto si ji vysvětlíme na příkladu. Vezměme si třeba molekulu oxidu uhličitého, která je namalovaná na obrázku. Srovnáme-li elektronegativity uhlíku a kyslíku, zjistíme, že atom kyslíku je elektronegativnější. Proto při úplné polarizaci vazeb (tedy myšlenkově tvoříme vazby iontové) by jeden atom kyslíku získal dva elektrony od uhlíku, jeden za každou vazbu. Oxidační číslo kyslíku je tedy –II. Atom uhlíku by o čtyři elektrony přišel, každý kyslík mu dva vezme, a proto má oxidační číslo +IV. Nezapomínejte, že elektron je záporná částice . Oxidační čísla se značí římskými číslicemi.
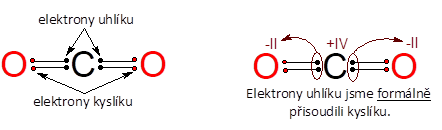
Odvození oxidačních čísel atomů v molekule oxidu uhličitého.
Ještě jednou si postup vysvětlíme na trochu složitější molekule kyseliny sírové H2SO4. Každý z atomů kyslíku, které se váží na síru dvojnou vazbou, by síře bral po dvou elektronech, protože mají vyšší elektronegativitu. Atomy kyslíku, které jsou na síru navázány jednoduchou vazbu, si vezmou jeden elektron od síry a jeden od vodíku a budou mít tedy oxidační číslo také –II. Když to správně posčítáme, oxidační číslo vodíků bude +I, kyslíků –II a síry +VI.
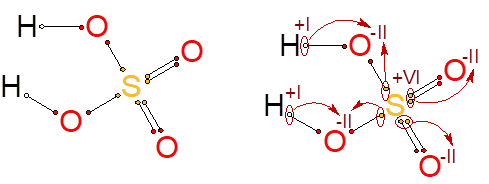
Odvození oxidačních čísel pro kyselinu sírovou.
Základní pravidla:
Otázka k zamyšlení 15: Jak byste zdůvodnili první dva body pravidel?
Za chvilku si jistě všimnete, že některé prvky mají svá oblíbená oxidační čísla. Třeba vodík se ve sloučeninách v drtivé většině případů vyskytuje v čísle +I a kyslík –II, ale pozor má to výjimky:-)
Chemické názvy prakticky všech anorganických látek se skládají z podstatného a přídavného jména. Podstatné jméno vyjadřuje typ sloučeniny (kyselina, oxid, hydroxid…) a přídavné jméno vyjadřuje, od jakého prvku byla tato sloučenina odvozena (sírová, uhličitý, sodný…). Oxidační číslo v přídavném jméně poznáme snadno podle již zmíněných koncovek.
Koncovky pro jednotlivá oxidační čísla.
|
oxidační číslo |
koncovka |
příklad |
|
I |
-ný |
oxid sodný NaI2O-II |
|
II |
-natý |
oxid vápenatý CaIIO-II |
|
III |
-itý |
oxid hlinitý AlIII2O-II3 |
|
IV |
-ičitý |
oxid titaničitý TiIVO-II2 |
|
V |
-ičný, -ečný |
oxid dusičný NV2O-II5 |
|
VI |
-ový |
oxid chromový CrVIO-II3 |
|
VII |
-istý |
oxid chloristý ClVII2O-II7 |
|
VIII |
-ičelý |
oxid osmičelý OsVIIIO-II4 |
Odpověď 15: Pokud máme samostatně stojící prvky, mohou nastat dva případy. Prvek je tvořen atomy (He, Ne…) nebo molekulami (Cl2, P4, S8). V obou případech bychom při počítání oxidačních čísel nemohli nikomu přisoudit elektrony navíc, a proto mají oxidační čísla 0. U atomových prvků nemáme vazby, u molekulových máme shodné hodnoty elektronegativit.
Nulový součet oxidačních čísel atomů v molekule vychází z principu určování oxidačních čísel. My jednotlivé elektrony pouze myšlenkově přemisťujeme (neubíráme, nepřidáváme), a proto pokud byla molekula neutrální na počátku, musí být neutrální i po našem myšlenkovém zásahu.
Úkol: Naučte se koncovky pro oxidační čísla. Naučit neznamená, že je dokážete vyjmenovat po sobě. Naučit znamená, že když jste tázáni na koncovku –ový, střelhbitě vám naskočí, že je to koncovka pro oxidační číslo VI. Čím lépe se to naučíte, tím snáze vám půjde celá anorganická chemie.
Další kapitola:6.1 Názvosloví dvouprvkových sloučenin
