Přepočty koncentrací
Jednou z nejčastějších komplikací, které budete v chemických příkladech čelit, je, že každá látka bude mít koncentraci zadanou jiným způsobem. Proto se naučíme koncentrace přepočítávat. Zkusme se zamyslet nad tím, jak hmotnostní zlomek přepočítáme na molární koncentraci.
Vyjdeme z vzorce pro hmotnostní zlomek
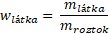
Hmotnost látky vyjádříme pomocí látkového množství a molární hmotnosti. Hmotnost roztoku pak jako součin jeho hustoty a objemu.
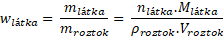
Vztah pro molární koncentraci je
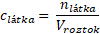
Tento výraz ale ve vztahu pro hmotnostní zlomek máme. Proto podíl n/V můžeme nahradit c a výsledný vztah je na světě.
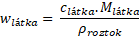
Vztah je to jednoduchý a hlavně dá se velmi snadno odvodit. Je tu však jeden háček a tím jsou jednotky. Víme již, že hmotnostní zlomek je bezrozměrný, proto i pravá strana výrazu musí být bezrozměrná. Zkusme si dosadit jednotky a uvidíme, zda se nám všechny pokrátí.
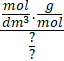
Je vidět, že to trochu nesedí. Moly se nám pokrátí, ale aby se nám pokrátil i zbytek, musíme hustotu uvádět v jednotkách g/dm3. To zas nebude takový problém, protože číselně je to stejné jako kdybychom ji uvedli v častější jednotce kg/m3. Jinými slovy třeba hustota vody je 1000 kg/m3= 1000 g/dm3.
Dávejte si na tu hustotu pozor. Je to nejčastější chyba v tomto typu příkladů. Pokud ji uvedete chybně, výsledek vám vyjde 1000krát chybně.
Příklad: Určete molární koncentraci 98% kyseliny sírové, která má hustotu ρ98%= 1,822 g . cm-3.Nejprve zápis
w(H2SO4) = 0,98
ρ98%= 1,822 g . cm -3
c = ? mol . dm-3
Napíšeme si vztah a uvědomíme si, jaké veličiny máme zadané a jaké ještě budeme potřebovat. Protože počítáme c, je nutné vztah upravit.
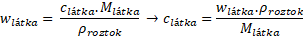
Určitě musíme dopočítat molární hmotnost kyseliny sírové.
M(H2SO4) = 2 . 1 + 32 + 4 . 16 = 98 g . mol-1
Dosadíme do vztahu a dáme pozor, v jakých jednotkách dosadíme hustotu.
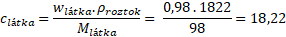
Molární koncentrace 98% roztoku kyseliny sírové je c(H2SO4) = 18,22 mol . dm-3.
Zkuste sami:
Další kapitola:
8 Slovo závěrem
