Koordinačně – kovalentní vazba
Kromě kovalentní vazby či iontové vazby existuje v celé řadě sloučenin i jiný typ vazby a to je vazba koordinačně-kovalentní . Pravidla hry jsou stejná jako u kovalentní vazby. Atomy se musí přiblížit na vhodnou vzdálenost a vytvořit vazebný elektronový pár. Rozdíl však spočívá v tom, že zatímco u vazby kovalentní každý z vazebných partnerů přispívá jedním elektronem do vazebného páru, u vazby koordinačně-kovalentní jeden z vazebných partnerů poskytuje celý vazebný pár a druhý poskytuje pouze svůj prázdný (vakantní) orbital. Z tohoto důvodu se běžně používá i alternativní název a to je vazba donor-akceptorová .
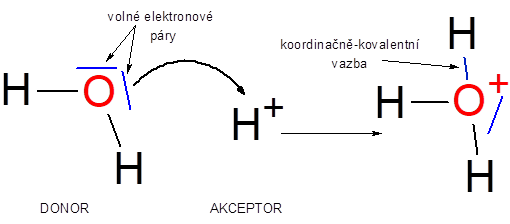
Vznik oxoniového kationu H3O+.
Vazbu si ukážeme na důležité částici, která je zodpovědná například za kyselost kyselin – oxoniovém kationu H3O+. Jak vidíme na obrázku, molekula vody má na atomu kyslíku dva volné elektronové páry a přibližuje se k ní vodíkový kation, který již nemá žádný elektron a tudíž jeho elektronový obal (atomový orbital) je zcela prázdný. Když se částice dostanou dostatečně blízko, kyslík (donor – dárce) poskytne celý elektronový pár a vodíkový kation (akceptor-příjemce) jej přijímá. Takto vzniká koordinačně-kovalentní neboli donor-akceptorová vazba. Důležitá poznámka. Po vzniku vazby ji již nejsme schopni odlišit od ostatních. Tedy u oxoniového kationu nepoznáme, které dvě vazby vznikly jako kovalentní a která vznikla jako koordinačně-kovalentní.
Další kapitola:5.4 Kovová vazba
