Molární koncentrace
Hmotnostní a objemový zlomek a základní hrátky s chemickými veličinami už máme zopakovány a nyní je čas na zavedení nového vyjádření složení roztoku. Molární koncentrace. Toto vyjádření je velmi používané, protože nám umožňuje velmi snadno spočítat, jaké látkové množství v našem objemu roztoku vlastně máme. Jak to funguje?
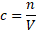
Protože dělíme látkové množství objemem, snadno odvodíme, že jednotkou molární koncentrace je mol . dm-3(kolik mol látky mám rozpuštěno v jednom litru roztoku).
Jednoduchý příklad: Rozpustili jsme 2 g dusičnanu stříbrného ve 100 ml vody. Kolika molární roztok jsme připravili?
Vyjdeme ze vzorečku.
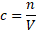
Objem známe. Látkové množství si snadno spočítáme.
M(AgNO3) = M(Ag) + M(N) + 3 . M(O) = 107,87 + 14 + 3 . 16 = 169,87 g . mol-1
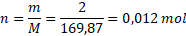
Dosadíme do vzorečku.
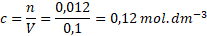
Koncentrace připraveného roztoku dusičnanu stříbrného je 0,12 mol . dm-3.
Můžete se také setkat se zápisem c(AgNO3) = 0,12 M. V tomto případě M neznamená molární hmotnost, ale jednotku molární koncentrace mol . dm-3. Protože je to matoucí, tak by se písmeno M pro jednotku koncentrace správně nemělo používat. Ale je to kratší a velmi lákavé, tak to chemikům i v současnosti občas ujede :-)
Střední příklad: Určete molární koncentraci vody.
Trošku málo informací pro výpočet, ale tím se nenecháme odradit. Co víme o vodě? Vzorec H2O, hustota 1 g.cm-3. To nám bude stačit.
Nejprve si zvolíme objem, třeba 1 dm3. Objem si můžu zvolit jakýkoliv. Je totiž jedno, zda vody budu mít hrnek nebo bazén, pořád bude mít stejné složení a tedy i stejnou molární koncentraci.
V = 1 dm3= 1000 cm3. Kolik ten litr vody bude vážit? Všichni víme, že 1 kg tedy m = 1000 g.
Pro fanoušky vzorečků
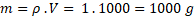
Kolik je to tak mol?
M(H2O) = 2 . 1 + 16 = 18 g . mol-1
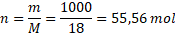
Protože jsme si chytře zvolili objem jednoho litru, molární koncentrace a látkové množství se nám budou číselně rovnat. Molární koncentrace vody je tedy 55,56 mol . dm-3. Kdo to v tom nevidí, nevadí, dosadíme do vzorečku.
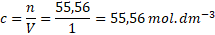
Molární koncentrace čisté vody je c = 55,56 mol . dm-3.
Těžší příklad: Provádím reakci KI s Pb(NO3)2, kterou mi vzniká PbI2a KNO3. K dispozici mám 50 ml roztoku Pb(NO3)2o molární koncentraci c(Pb(NO3)2) = 0,5 mol . dm-3a dále roztok KI o molární koncentraci c(KI) = 0,25 mol . dm-3. Kolik budu muset použít roztoku KI, aby mi zreagoval všechen Pb(NO3)2?
Zmatení je na místě. V klidu si přečtěte zadání ještě jednou a pomalu si to rozebereme. Nejprve je nutné napsat rovnici děje, který zkoumáme.
Všimněte si, že se záměrně vyhýbám pojmenování našich látek. Tak šup, zopakovat názvosloví a látky pojmenovat.
Do rovnice jsme museli dopsat dvě dvojky (označeny červeně) a to proto, aby se nám rovnice „rovnala“. Pokud bychom to neudělali, na levé straně rovnice bychom měli jiný počet atomů než na pravé. My víme, že chemickou reakcí se nám atomy přeskupí, ale nemůžou nám žádné vzniknout či zaniknout. Doplněním dvojek jsme rovnici vyrovnali. Zatím se, prosím, smiřte s takto jednoduchým vysvětlením, podrobněji nás to čeká později.
Z rovnice vidíme, že na jeden mol Pb(NO3)2potřebujeme dva moly KI. Dobré vědět. Kolik ale máme Pb(NO3)2? Víme koncentraci i objem roztoku této soli, takže to umíme spočítat.
Upravíme vzoreček a dosadíme
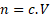
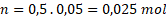
Pozor na objem, dosazujeme v dm3.
Protože KI potřebujeme dvojnásobek, je třeba 0,05 mol KI.
Roztok KI má koncentraci c(KI) = 0,25 mol . dm-3. Kolik ho tedy musím odměřit, abych tam těch 0,05 mol měl?
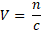
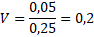
Bude potřeba 0,2 dm3, neboli 200 cm3roztoku KI.
Další příklady:
Další kapitola:
7.4 Přepočty koncentrací
