Van der Waalsovy interakce
Představme si dvojatomovou molekulu A-B s tím, že atom A má
vyšší elektronegativitu než atom B. Elektrony budou umístěny
blíže atomu A a zapříčiní jeho parciální záporný náboj. Atom
B bude mít parciální kladný náboj. Nyní opustíme chemii a
koukneme se na situaci očima fyzika. Vidíme objekt s kladnou
a zápornou částí. Tomu se ve fyzice říká dipól, a protože je
tento dipól neměnný, stálý, můžeme použít termín
permanentní dipól
.
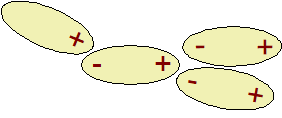
První z van der Waalsových interakcí se nazývají
Coulombické síly
. Je to prosté elektrostatické přitahování dvou
permanentních dipólů. Kladná část jednoho dipólu je
přitahována k záporné části jiného.
Coulombické interakce.
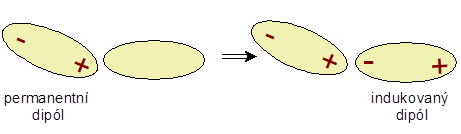
Druhý typem van der Waalsových interakcí jsou
indukční síly
. Permanentní dipól indukuje vznik dipólu původně nepolární
molekuly. Už víme, že elektrony nejsou v molekulách na
pevno, ale pohybují se v molekulových orbitalech. Proto,
když přiblížíme permanentní dipól k neutrální molekule,
kladný pól permanentního dipólu bude přitahovat elektrony
neutrální molekuly. Ty se za ním posunou a vytvoří se tak
indukovaný dipól. Permanentní a indukovaný dipól se budou
opět přitahovat.
Indukovaný dipól.
Třetí a poslední typ van der Waalsových interakcí se nazývá
disperzní síly.
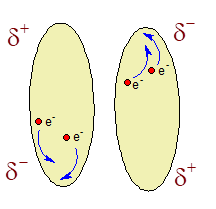
Tentokrát máme na počátku dvě neutrální molekuly. Jejich
elektrony se pohybují ve svých molekulových orbitalech a my
nyní uděláme takový jednoduchý myšlenkový krok – zastavíme
čas. Při zastaveném času se elektrony přestanou pohybovat, a
když si obě molekuly prohlédneme blíže, zjistíme, že vlivem
náhodného uspořádání elektronů molekuly přeci jenom malé
náboje mají. Tyto náboje jsou podstatou disperzních sil a
těmito náboji se budou molekuly krátce přitahovat. Když opět
pustíme čas, elektrony se zase přeskupí jinak, ale vždycky
někde v molekule vznikne malý náboj, který i navenek
neutrální látky drží u sebe.
Vlivem náhodného pohybu elektronů v molekulách vznikají
malé krátkodobé náboje, které jsou příčinou disperzních
sil.
Další kapitola:
5.5.2 Vodíkový můstek