Periodická soustava prvků
Nacházíme se v druhé půlce 19. století. Mnoho prvků již je objeveno a přibývají další. Některé mají velmi podobné vlastnosti, dokonce jsou prakticky nerozlišitelné. Některé se chovají velmi výstředně. Máme prvky plynné, kapalné, pevné a jediné co nemáme je nějaký řád, do kterého by všechno zapadalo. Až jednoho dne se ruský chemik Dmitrij Ivanovič Mendělejev pokoušel sepsat učebnici anorganické chemie a přemýšlel, jak tuto knihu uspořádat. Dlouho marně tápal, až ho jednou napadlo seřadit prvky svisle podle hmotností atomů a zároveň prvky s velmi podobnými vlastnostmi napsat vedle sebe. Takto vznikla první periodická soustava prvků. Od té naší se sice lišila (např. otočením o 90 °), ale nějak se začít muselo. Mendělejevova tabulka vyvolala velké pozdvižení ve vědecké komunitě a mnozí učenci ji odmítali. Postupem času se však ukázalo, že skutečně vlastnosti prvků jsou řízeny periodickým zákonem a že měl Mendělejev pravdu.
Periodický zákon nám říká, že vlastnosti prvků jsou periodickou funkcí protonových čísel. Tedy že se vlastnosti prvků s jejich rostoucí atomovou hmotností po určitě době opakují. Jako příklad nám může posloužit hned první skupina PSP – alkalické kovy.
Vypadají velmi podobně, jsou tak měkké, že se dají stříhat nůžkami. Všechny tyto kovy bouřlivě reagují s vodou za vzniku hydroxidů a uvolnění vodíku.


Dalším charakteristickým rysem alkalických kovů je, že dokáží barvit plamen. Vlevo je karmínově červený lithiový plamen, vpravo žlutý plamen sodíkový.
Příčina periodického zákona je skrytá ve sktruktuře elektronových obalů jednotlivých prvků. Tuto strukturu si podrobně probereme později. Nyní nám bude stačit, když si uvědomíme, že pokud mají prvky stejné uspořádání valenční vrstvy, chovají se stejně nebo velmi podobně, jak už jsme si řekli dříve. Ale pro jistotu ještě jednou. Každý prvek se snaží být co nejstabilnější a nejlépe svým elektronovým uspořádáním vypadat jako vzácný plyn a své chování podřizuje tomuto cíli. Proč zrovna jako vzácné plyny? Ty mají totiž svoji valenční vrstvu zcela zaplněnou, kompletní, což je energeticky nejvýhodnější. Nemají tedy potřebu již nijak reagovat.
Tak třeba sodík má ve své valenční vrstvě jediný elektron, protože je na svém řádku PSP první. Jak může docílit toho, že bude vypadat jako vzácný plyn? Inu snadno, někomu předá jeden elektron, stane se z něj sodný kation a bude elektronovým uspořádáním vypadat jako neon. A jak jsou na tom ostatní prvky z první skupiny? Úplně stejně. Proto alkalické kovy nikdy v přírodě nenajdeme ryzí, stačí kapka vody a hned se přemění na kationy.
Druhá skupina se chová úplně stejně s tím, že se musí zbavit hned dvou elektronů. Z vápníku se odevzdáním elektronů stává vápenatý kation, který svým uspořádáním odpovídá argonu.
Druhou cestou, kterou se prvky mohou vydat, je elektrony přijímat. Třeba chlor má ve své valenční sféře 7 elektronů a jen jeden jediný mu chybí k tomu, aby elektronově odpovídal vzácnému plynu argonu. Proto, pokud má možnost, okamžitě elektron přijímá a stává se z něj chloridový anion. Některé prvky mají obě dvě možnosti, elektrony přijmout i odevzdat, a to činí chemii tak krásnou.
Původní Mendělejevova tabulka obsahovala prázdná místa – důkaz jeho geniality. Prostě dosud nebyl objeven prvek, který by vhodně pasoval do daného okénka. Roku 1875, 6 let po uvedení tabulky, objevil francouzský chemik Lecoq de Boisbaudran nový prvek, který pojmenoval po své zemi gallium. Při publikování svého objevu uvedl základní fyzikálně-chemické parametry prvku a byl se svou prací spokojen. Krátce poté mu však přišel dopis od ruského profesora, který mu sice pogratuloval k objevení nového prvku, ale zároveň ho upozornil, že ony fyzikálně-chemické parametry, zejména atomová hmotnost, budou patrně chybné. Mendělejevovi „nepasovaly do tabulky“. Lecoq se velmi podivil, že někdo, kdo jeho gallium v životě neviděl, má pochybnosti o přesnosti jeho měření, nicméně jak se na vědce sluší a patří, parametry přeměřil. Mendělejev měl pravdu a tento příběh byl jedním z mnoha, který definitivně potvrdil platnost periodického zákona a Mendělejevovy PSP.
Celá PSP je tvořena 18 sloupci, 7 řádky tvořícími tabulku a 2 řádky, které se běžně uvádějí pod tabulkou. Řádkům se říká periody , a jak už jsme zmínili, odpovídají vrstvám elektronového obalu. Sloupcům se pak říká skupiny .
První dvě skupiny prvků se označují pojmem s prvky , 3. - 12. skupinu tvoří d prvky , 13. - 18. skupinu tvoří p prvky a dva vydělené řádky jsou označovány jako f prvky . Toto označení vyplývá ze struktury jejich elektronových obalů. Zatím jej nebudeme potřebovat, ale ať to máme kompletní.
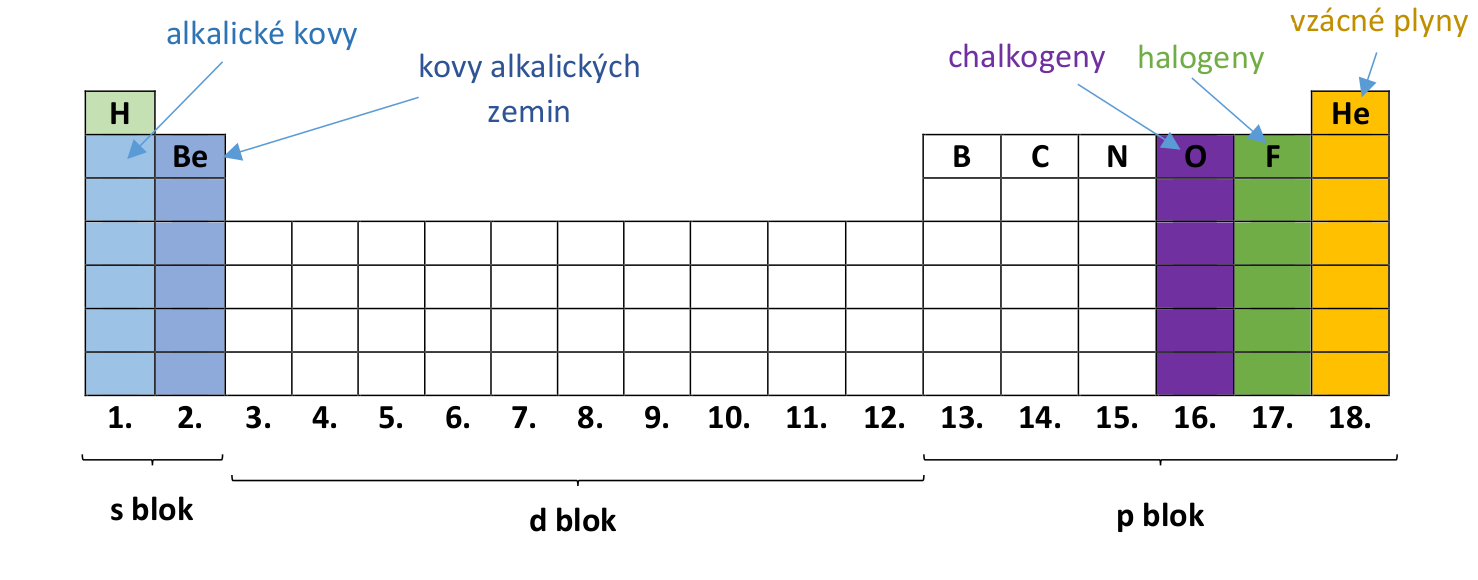
Z historických a často i z praktických důvodů mají některé skupiny svoje vlastní názvy, které se běžně používají. Tak popořádku:
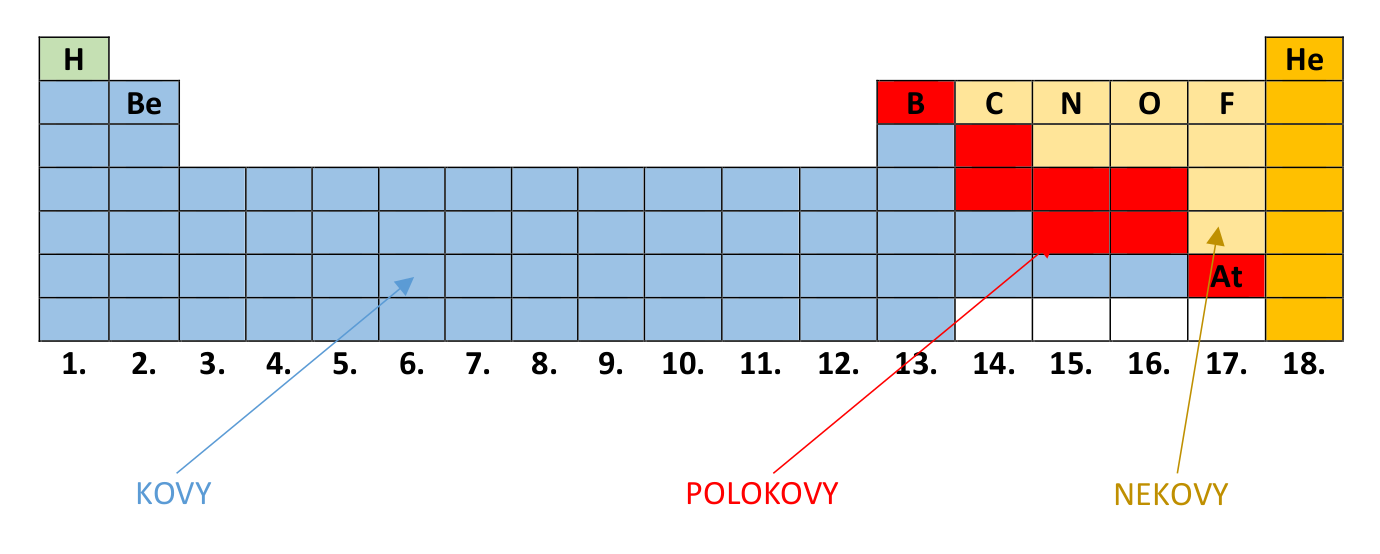
Poslední, co zmíníme, je skutečnost, že podle umístění prvku v PSP velmi snadno posoudíme, zda je prvek kov, polokov či nekov. Nejprve opakování. Co musí slušně vychovaný prvek splňovat, abychom ho označili pojmem kov ? Tak předně musí vodit a to nejen elektřinu ( elektrická vodivost ), ale i teplo ( tepelná vodivost ). Dále musí být kujný ( kujnost ), což lapidárně řečeno znamená, že když do kovu bouchnete kladivem, tak se neroztříští jako třeba sklo, ale změní svůj tvar. S kujností se pojí i tažnost . Kovové materiály lze vytáhnout do tenkých folií (třeba alobal nebo staniol) nebo drátků. Poslední velmi charakteristickou vlastností je kovový lesk . Polokovy jsou na rozdíl od kovů často velmi křehké a málo vodivé. Nicméně jsou vhodným materiálem pro výrobu tzv. příměsových polovodičů. Nekovy nemají vlastnosti kovů, nebo mají jen některé. Celou PSP můžeme rozdělit na dvě nestejně velké části. Dělicí linie vede od boru k astatu. Prvky umístěné nalevo od linie, jsou kovy (Že se nám tam nachomýtl zas ten vodík, jste si jistě všimli. Vodík je samozřejmě nekov). Prvky umístěné napravo jsou nekovy. Prvky dělící linie jsou polokovy.
Úkol: Naučte se značky a umístění prvků d – bloku.
Další kapitola:5 Chemická vazba
