Historické modely atomu
Otázka z čeho se vlastně skládá hmota, trápila vědce hodně dlouho. Jako první rozumný model atomu se udává Thomsonův model atomu . Joseph John Thomson v roce 1897 objevil elektron, miniaturní částici nesoucí záporný náboj. Na základě tohoto objevu Thomson navrhl v roce 1904 model, ve kterém byl atom tvořen kladnou hmotou, ve které byly náhodně rozmístěny elektrony. Právě toto náhodné rozmístění elektronů dalo vzniknout alternativnímu názvu tohoto modelu – model pudinkový, protože elektrony připomínaly rozinky náhodně rozmístěné v britském vánočním pudinku. Z dnešního pohledu je tento model spíše úsměvný, ale v tehdejší době znamenal značný pokrok ve vnímání hmoty.
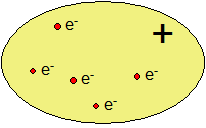
Thomsonův model atomu
Vždy, když je v přírodních vědách představena nějaká teorie nebo nějaký model, je nutné ji experimentálně ověřit. Pokud experimenty souhlasí s teorií, teorie se považuje za platnou. Pokud byť i jen jeden jediný experiment s teorií nesouhlasí, teorie je chybná a musí být nahrazena teorií novou. Proto i Thomsonův model musel být experimentálně ověřen. Tento úkol dostala dvojice vědců Hans Geiger a Ernest Marsden, kteří pracovali v laboratoři věhlasného Ernesta Rutherforda. Princip slavného Geiger-Marsdenova experimentu byl jednoduchý a je zobrazen na obrázku.
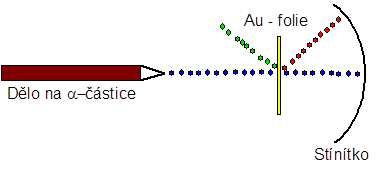
Geiger – Marsdenův experiment
Pánové si vzali dělo, které produkovalo α-částice, tedy jádra helia42He2+(opakování indexů neuškodí: α-částice má dva protony a dva neutrony v jádře, ale protože je to jádro helia, je zbavená elektronů a to jí dává náboj 2+). Proudu těchto částic postavili tenoučkou zlatou folii, za kterou umístili stínítko. Předpoklad byl jednoduchý. Hmotné α-částice proletí víceméně rovnoměrně rozprostřenou hmotou zlatých atomů folie, aniž by změnily dráhu. Reálné pozorování skutečně potvrdilo, že mnoho částic proletělo dle předpokladu (modrý paprsek v obrázku), ale kupodivu byly pozorovány i částice, jejichž dráhy se významně odchýlily (červený paprsek v obrázku) a dokonce i částice, které fólií vůbec neprošly, ale odrazily se (zelený paprsek v obrázku). Odchýlené a odražené částice Thomsonův model nebyl schopen vysvětlit, tedy musel být nahrazen modelem novým. Na základě pozorování svých kolegů, nový model navrhl v roce 1911 Ernest Rutherford. Rutherfordův model atomu se někdy také nazývá model planetární, protože velmi připomíná Sluneční soustavu. Rutherford jako první navrhl existenci atomového jádra, do kterého je soustředěna většina hmotnosti atomu, a vysvětlil odchýlené a odražené paprsky. Pokud α-částice prolétla elektronovým obalem, prakticky nezměnila směr. Pokud narazila na jádro, změnila směr nebo se odrazila.
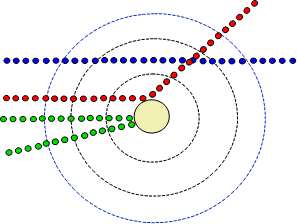
Geniální představa Rutherfordova modelu atomu a jednotlivé paprsky.
Slabina Rutherfordovy představy, že elektrony obíhají kolem jádra jako planety kolem Slunce, spočívá ve stabilitě, respektive nestabilitě atomu. Elektron pohybující se kolem jádra by byl dostředivě urychlován, což by mělo za následek uvolňování energie elektronu do okolí. Elektron by se potom spirálovitě zhroutil do jádra. Zhroucení pro elektron nejjednoduššího atomu vodíku by trvalo asi 10-16sekundy a někde tedy musí být chyba.
Řešení navrhl dánský fyzik Niels Bohr, který vzal planetární model a upravil jej několika postuláty.
Postulát je tvrzení, které se považuje za pravdivé a které zároveň nelze dokázat. Něco jako: Maminka má vždycky pravdu. Nemůžete nikdy dokázat, že by maminka na úplně všechny otázky odpověděla správně, ale nikdo o tom snad nepochybuje?!
První Bohrův postulát říká, že přeci jenom existují takové dráhy elektronů, po kterých mohou elektrony obíhat, aniž by ztrácely energii. Těmto drahám se běžně říká energetické hladiny . Tyto dráhy však nemají náhodný, ale přesně daný poloměr. Druhý postulát se týká přechodu elektronu z hladiny na hladinu. Přechod elektronu z jedné hladiny na druhou je proto spojen s výměnou přesně daného balíku energie (foton), který odpovídá rozdílu energií obou hladin. Pokud elektron přechází z energeticky nižší hladiny na hladinu vyšší, říká se tomu excitace a elektron musí přijmout energii. Obrácený proces, přechod elektronu z energeticky vyšší hladiny na hladinu nižší, se nazývá deexcitace a je spojen s uvolněním energie. Toto energetické záření může být v intervalu pro viditelné světlo, a proto jej můžeme vnímat jako barvu. Proto je oheň zbarvený do žluta. Může za to deexcitace sodných kationů, které uvolňují fotony, které vnímáme jako žluté světlo. Ostatní ionty mohou barvit plamen jinak.
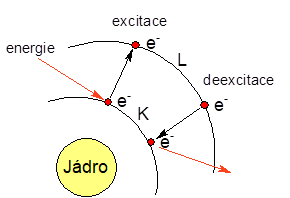
Schématické znázornění excitace a deexcitace.
Bohrův model velmi dobře popisuje atom vodíku a analogické částice. Selhává však pro složitější částice, protože není např. schopen zahrnout vzájemné odpuzování elektronů víceelektronových částic. Bohrův model byl velmi brzy nahrazen kvantově mechanickým modelem , který je platný dodnes. Základní popis a principy kvantově-mechanického modelu si popíšeme později. Nyní jen uvedeme, že tento model používá pravděpodobnostní vyjádření výskytu elektronu. Na základě přírodních zákonů nedokážeme totiž určit úplně přesně, kde elektron je. Není to chyba měření nebo výpočtů, ale princip, který neúprosně v kvantovém světě platí. Situace ale není tak zoufalá. Dokážeme vymezit prostor, ve kterém se elektron bude s vysokou pravděpodobností vyskytovat. Tomuto prostoru se říká orbital . Orbitaly atomů mohou mít jednoduchý tvar koule, jako je třeba orbital atomu vodíku na obrázku vlevo, ale i tvary velmi komplikované.
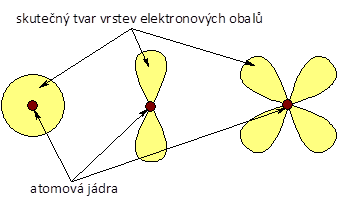
Orbitaly ve skutečnosti mohou mít různý tvar, kromě koule (orbital s) mohou mít také tvar prostorové osmičky (orbital p), či dokonce dvou prostorových osmiček (orbital d).
Další kapitola:4.3 Charakteristiky atomů a molekul
