Vznik chemické vazby
Představme si dva atomy vodíku. Už jsme si řekli, že by atom vodíku, stejně jako všechny ostatní prvky, nejraději elektronovým uspořádáním odpovídal vzácnému plynu. Aby se vodík podobal nejbližšímu heliu, musí někde přijmout elektron. Ale jak to udělat? Pokud se naše dva atomy přiblíží na dostatečně krátkou vzdálenost, dojde k překryvu jejich orbitalů. Protože je to pro atomy výhodné, jejich atomové orbitaly se spojí (můžete si to představit jako spojení dvou menších bublin do bubliny větší) a vznikne jeden velký molekulový orbital, ve kterém budou umístěny oba dva vodíkové elektrony. Atomy vodíku se rozhodly svoje elektrony sdílet a vytvořily molekulu vodíku. Kolem každého jádra tak budou poletovat dva elektrony ( vazebný elektronový pár ), stejně jako u helia, a oba dva vodíci budou spokojení. Vzájemné sdílení elektronů, které jsme si teď popsali, je principem kovalentní vazby .
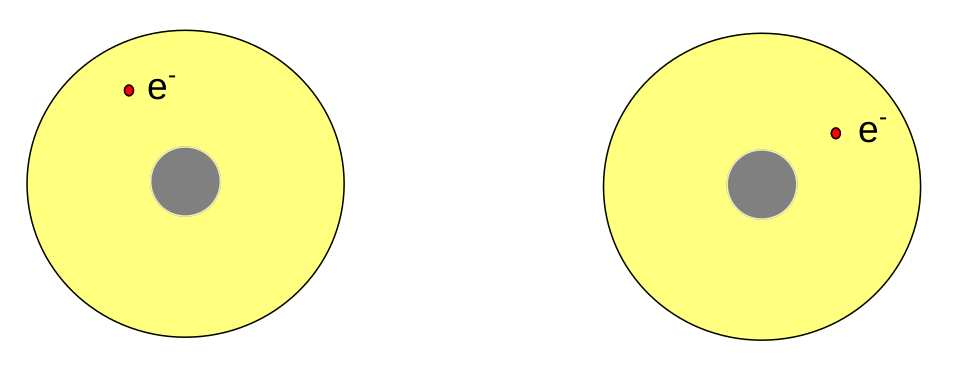
Atomy vodíku jsou daleko od sebe a prakticky na sebe nepůsobí.
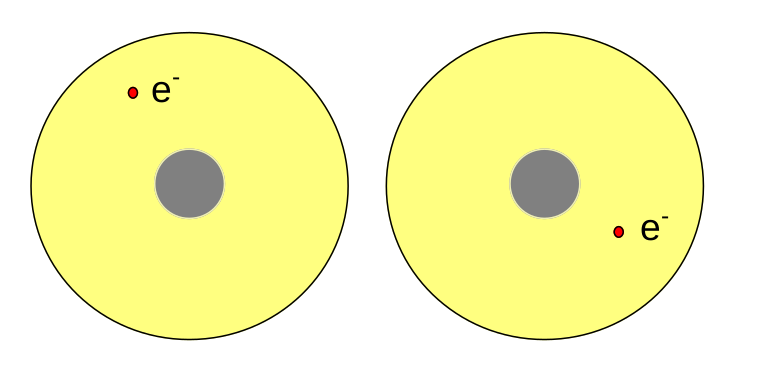
Při přiblížení atomů se začnou přitahovat. Záporný elektron jednoho atomu přitahuje kladné jádro druhého atomu a obráceně.
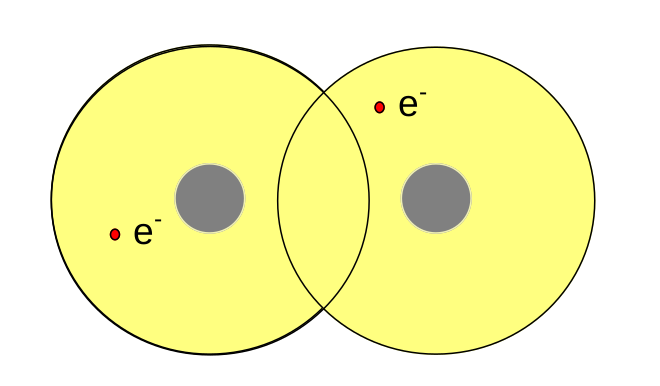
Při určité vzdálenosti dojde k překryvu atomových orbitalů jednotlivých atomů a vznikne orbital molekulový.
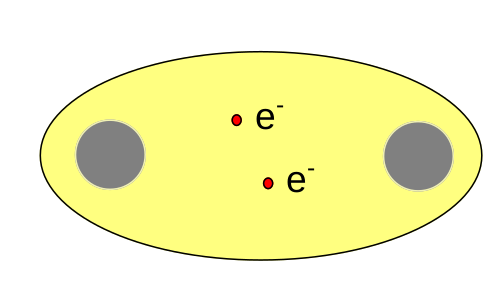
Molekula vodíku. Vazebné elektrony jsou umístěny v molekulovém orbitalu a nachází se mezi jádry jednotlivých atomů.
Schématické znázornění vzniku kovalentní vazby mezi atomy vodíku.
V molekule vodíku H2máme vazbu jednoduchou , tvořenou dvěma vazebnými elektrony. Celá situace se ale může opakovat jako třeba u molekuly kyslíku O2. Kyslík má ve své valenční vrstvě šest elektronů. Aby vypadal jako nejbližší vzácný plyn, neon, musí si tedy ještě ke dvěma elektronům dopomoci. Vyřešil to tak, že se spojí dva atomy kyslíku vazbou dvojnou , tedy sdílí dva vazebné elektronové páry. Na obrázku je znázorněna molekula kyslíku a opravdu si můžete ověřit, že kolem každého atomu kyslíku se vyskytuje osm elektronů stejně, jak to má neon. Dva vazebné elektronové páry (ty sdílí s druhým atomem) a dva páry nevazebné, které si ponechal ve svém elektronovém obalu. Dusík tvoří vazbu trojnou , s úplně stejným příběhem jako předešlé dva prvky. Vazba čtverná sice již byla experimentálně potvrzena, ale je nestabilní a prozatím spíše na okraji vědeckého zájmu.
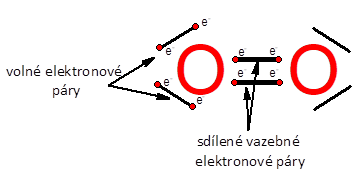
Kyslík si sdílením dvou vazebných elektronových párů doplní elektronový oktet a elektronově odpovídá vzácnému plynu neonu.
Prvky se tedy váží tak, aby se co nejvíce přiblížily svým elektronovým uspořádáním vzácnému plynu. Tomuto se říká oktetové pravidlo , protože vzácné plyny mají úplně zaplněnou svoji valenční vrstvu a to obvykle osmi elektrony.
Když do toho budeme šťourat, tak si všimneme, že helium má pouze 2 valenční elektrony – někdy se můžete setkat s pojmem duetové pravidlo. Neon a argon mají vskutku 8 valenčních elektronů – oktetové pravidlo. A pak začínají zmatky. U kryptonu a xenonu vidíte v PSP 18 elektronů – 18-ti elektronové pravidlo. Pak ale 10 z nich (ty ve 3. - 12. skupině) by se z důvodů, které si povíme později, neměly uvádět mezi valenční. A o radonu už radši ani nemluvím… Proto pojďme se dohodnout, že všemu budeme říkat oktetové pravidlo a budeme tím myslet, že se prvky vážou tak, aby se co nejvíce elektronově podobaly vzácnému plynu. Pokud se bude nějaký kovaný chemik cítit tímto zjednodušením dotčen, nechť mě vyhledá.
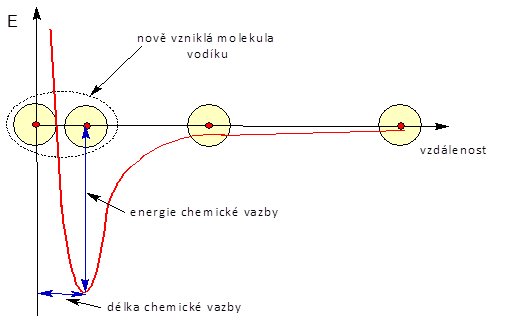
Energetický diagram vzniku chemické vazby.
Uvedený vznik molekuly vodíku můžeme popsat i z fyzikálního hlediska. Graf na obrázku znázorňuje závislost energie na vzdálenosti atomů vodíku. Když jsou vodíky daleko od sebe, prakticky na sebe nepůsobí a energie je nulová. Pokud atomy přiblížíme k sobě, začne být záporný elektronový obal jednoho atomu přitahován ke kladnému atomovému jádru druhého atomu. Čím kratší vzdálenost, tím silnější přitahování za současného uvolňování energie do okolí. V určité vzdálenosti dosáhne energie svého minima a vzniká chemická vazba . Energie, která se při vzniku chemické vazby uvolnila do okolí, se nazývá energie chemické vazby a obvykle bývá uvedena v J/mol. Tedy kolik energie se uvolnilo při vzniku jednoho molu vazeb. Když bychom chtěli tuto chemickou vazbu opět rozdělit, musíme energii dodat a to přesně stejné množství jako se uvolnilo. Energie, kterou dodáváme na rozštěpení vazby, se nazývá disociační energie a je až na znaménko shodná s energií chemické vazby. Pokud bychom atomy přiblížili ještě více, atomová jádra by se začala velmi silně odpuzovat a energie systému by vzrostla nade všechny meze. Vzdálenost atomových jader, kde má systém nejnižší energii, se nazývá délka chemické vazby a udává se v řádu pikometrů. Je to tedy takový kompromis mezi vzájemným přitahováním elektronových obalů a atomových jader jednotlivých atomů a odpuzováním jejich jader.
Další kapitola:5.2 Elektronegativita
