Vyjadřování složení směsí - objemový zlomek
Kromě hmotnosti je pro některé účely občas praktičtější používat objem. Z tohoto důvodu úplně stejně jako jsme zavedli hmotnostní zlomek, zavádíme zlomek objemový .
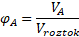
Otázka k zamyšlení 12: Jaké jsou nevýhody objemového zlomku?
Příklad: Roztok butanolu o objemu 70 cm3jsme připravili zředěním 8 cm3čistého butanolu vodou. Jaký je objemový zlomek butanolu v připraveném roztoku? (φbutanol= 0,114)
Příklad: Roztok byl připraven zředěním 20 g propanalu na celkový objem 50 cm3. Vypočítejte objemovou koncentraci roztoku. Hustota propanolu je ρpropanal= 797 kg . m-3. (50,1 obj. %)
Těžší příklad: Určete objemový zlomek roztoku, který vznikl smícháním 100 ml 12% (obj.) roztoku a 150 g 16% (obj.). Druhý z roztoků má hustotu ρ = 0,972 g . cm-3. (φ = 0,144)
Následující tabulka by se vám mohla občas hodit. Doporučuji umět tyto přepočty z hlavy, ušetří vám to čas a zbytečné chybky.
|
Veličina |
Jednotka |
|
hmotnost |
1 kg = 1 000 g, 1 tuna = 1 000 kg, 1 metrák = metrický cent = 100 kg |
|
délka |
1 m = 100 cm = 1 000 mm, mili = 1 000 mikro, 1 mikro = 1 000 nano |
|
objem |
1 m3= 1 000 dm3, 1 dm3= 1 000 cm3, 1 dm3= 1 l, 1 l = 1 000 ml, 1 cm3= 1 ml |
|
hustota |
kg/m3= 0,001 g/cm3, proto hustota vody je 1000 kg/m3= 1 g/cm3 |
Odpověď 12: Objemový zlomek má dvě hlavní nevýhody. První spočívá v tom, že objem na rozdíl od hmotnosti je závislý na teplotě. Tuto závislost má každá látka jinou, a proto různé látky reagují různě na stejnou tepelnou změnu. Důsledkem toho je změna objemového zlomku směsi. Druhá nevýhoda spočívá v tom, že 1 + 1 nemusí být objemově nutně dvě. Cože? Ano, je to tak. Představme si, že máme 20 dm3tenisáků a 20 dm3kuliček do airsoftových zbraní. Nyní to sesypeme dohromady a správně bychom měli mít 40 dm3směsi. Protože 20 a 20 je přeci 40. Jenže malé kuličky vyplní prostory mezi velkými tenisáky, což v důsledku způsobí, že budeme mít menší objem, než očekáváme. Tento fenomén se uplatňuje i u molekul a říká se mu objemová kontrakce . Malé molekuly vyplní prostory mezi velkými a objem směsi je poté menší, než je součet původních objemů jednotlivých složek.
Stejně jako existuje objemová kontrakce, existuje i objemová expanze. Tedy situace, kdy slijete 1 litr jedné látky, 1 litr druhé a výsledný roztok bude mít objem více než 2 litry. Nestává se to příliš často, ale stát se to může (např. sulfid uhličitý CS2a ethyl acetát). Příčina spočívá v tom, že molekuly do sebe vůbec „nepasují“, překážejí si a chtějí být o sebe co nejdále.
Další kapitola:4 Částicové složení látek a chemické prvky
