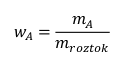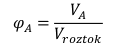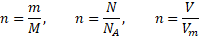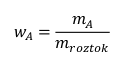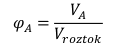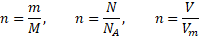Opakování hmotnostní a objemové koncentrace
Stručně a jasně, co byste si měli pamatovat.
Hmotnostní zlomek
wAje hmotnostní zlomek látky A,
mAje hmotnost látky Amroztokje hmotnost celého roztoku, tedy součet hmotností všech složek roztoku
součet hmotnostních zlomků všech složek roztoku je roven 1
hmotnostní zlomek chemicky čisté látky je roven 1. Již se nejedná o roztok.
Objemový zlomek
φAje objemový zlomek
VAje objem látky A
Vroztokje objem celého roztoku, získáme jej snadno, posčítáme objemy všech složek
součet všech objemových zlomků všech složek roztoku je roven 1
velká nevýhoda objemového zlomku spočívá v objemové kontrakci, tedy že pokud slijeme litr jedné a litr druhé látky, nemusíme nutně dostat dva litry roztoku
velká nevýhoda objemového zlomku také spočívá v jeho závislosti na teplotě. Každá složka roztoku může mít jinou teplotní roztažnost a proto je hodnota φAzávislá na teplotě.
Látkové množství
n je látkové množství, m je hmotnost typicky uváděná v g, M je molární hmotnost v g/mol, N je počet částic, NAje Avogadrova konstanta s hodnotou 6,022 . 1023mol-1, V je objem, Vmje molární objem a platí, že při dodržení standardních podmínek zaujímá 1 mol každého plynu 22,4 dm3.
Příklady:
Určete hmotnostní zlomek hydroxidu draselného v roztoku, který vznikl rozpuštěním 0,5 mol hydroxidu draselného v 350 ml vody. (w = 0,074)
Jak se změní hmotnostní zlomek roztoku dusičnanu stříbrného, když do 200 ml roztoku o w(AgNO3) = 0,05 přidáme 5 g této soli? Hustota 5% roztoku je ρ5%= 1,12 g.cm-3. (w = 0,071)
Jak se změní hmotnostní zlomek chloridu draselného v jeho 8% roztoku, pokud z 200 g toho roztoku odpaříme 20 ml vody? (w = 0,089)
Jaký je hmotností zlomek roztoku ethanolu, který má objemovou koncentraci uvedenou jako 40% (obj.)? Hustota ρ40%obj= 0,9481 g.cm-3, Hustota ρ100%obj= 0,7892 g.cm-3. (w = 0,332)
Určete látkové množství kyseliny fosforečné, které je obsažené ve 100 ml jejího 75% roztoku. Hustota tohoto roztoku je ρ75%= 1,58 g.cm-3. (n = 1,21 mol)
Kolik atomů neonu vyplní objem 50 dm3za standardních podmínek? (N = 1,344 . 1024)
Kolik mol uhlíku tvoří největší diamant na světe, který má 1 109 karátů? Kolik je to atomů? Jeden karát je 0,2 g. (n = 18,48 mol, N = 1,113 . 1025)
Jaký bude hmotnostní zlomek roztoku ethanolu, který vznikl smícháním 100 ml 10% (obj.) roztoku a 200 ml 20% (obj.)? Hustoty roztoků jsou ρ10%= 0,9847 g . cm-3, ρ20%= 0,9736 g . cm-3a ρ100%= 0,7892 g . cm-3. (w = 0,135)
Hořením síry vzniká oxid siřičitý dle následující rovnice:
S + O2→ SO
2
Kolik bylo spáleno atomů síry, když za standardních podmínek vzniklo 200 dm3oxidu siřičitého? (N = 5,377 . 1024)
Kolik vážil železný předmět (Fe), když jeho kompletním zrezivěním vzniklo 200 g rzi (Fe2O3. 3 H2O)? (m(Fe) = 104,54 g)
Další kapitola:
7.2 Výpočty ze vzorců