Atom a jeho stavba
Už jsme si řekli, že základní stavební jednotka hmoty je atom. Už samotný pojem atom, pocházející z řeckého a tomos , tedy nedělitelný, naznačuje, jak malá tako částice je. Pro představu tloušťka průměrného lidského vlasu by odpovídala zhruba milionu atomů vodíku postavených do řady. S rozvojem vědy se podařilo atom přeci jenom rozdělit. Ukázalo se, že prakticky veškerá hmotnost atomu je soustředěná v tzv. atomovém jádře , které nese kladný náboj. Jádro je tvořeno jadernými částicemi ( nukleony ) a to protony a neutrony . Protony nesou kladný náboj, zatímco neutrony jsou bez náboje. Už víme, že atom jako celek je elektroneutrální. Záporné částice, které vyrovnávají kladný náboj jádra, se nazývají elektrony a nacházejí se v elektronovém obalu . Hmotnost elektronu je mnohem menší než hmotnost protonu či neutronu. Protony, neutrony a elektrony se souhrnně nazývají elementární částice a v chemii si s nimi plně vystačíme. Současná fyzika dokázala rozštěpit i tyto částice a objevila kvarky, gluony, leptony či slavný Higgsův boson, ale to je již mimo náš obor.
|
Elementární částice |
Hmotnost částice (kg) |
Náboj |
Výskyt |
|
Proton (p) |
1,6726 . 10-27 |
Kladný |
V jádře |
|
Neutron (n) |
1,6749 . 10-27 |
Bez náboje |
V jádře |
|
Elektron (e-) |
9,109 . 10-31 |
Záporný |
V elektronovém obalu |
Kolik daný atom obsahuje elementárních částic, nám říkají různá čísla. Některé z nich snadno zjistíme pohledem na PSP (Pohled ani nepotřebujeme, přece ji všichni umíme z hlavy.). V levém dolním indexu značky prvku se uvádí protonové číslo Z , které nám říká počet protonů v jádře prvku a zároveň v kolikátém políčku je daný prvek v PSP. Protože je atom neutrální, musí nám protonové číslo zároveň udávat také počet elektronů v elektronovém obalu. V levém horním indexu se uvádí nukleonové číslo A , které nám udává počet nukleonů. Někdy bývá v pravém horním indexu uvedeno neutronové číslo N , které říká počet neutronů. Toto číslo se ale většinou vynechává, protože jej snadno můžeme zjistit, pokud od nukleonového čísla odečteme číslo protonové.

Otázka k zamyšlení 12: Na co jsou v atomovém jádře neutrony?
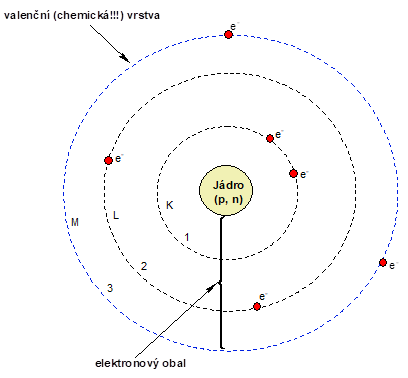
Uspořádání atomu je ukázáno na obrázku. Kolem malého hmotného jádra je obrovský elektronový obal . V prvním přiblížení si atom můžeme představit jako kouli složenou z jednotlivých vrstev, na kterých si lebedí elektrony. Jednotlivé vrstvy se často značí písmeny K, L, M, …. či se číslují s tím, že vrstva K neboli 1 je nejblíže atomovému jádru. Elektron umístěný na této vrstvě je tedy nejvíce přitahován jádrem a má nejméně energie. Čím jsou elektrony umístěny na vzdálenějších vrstvách, tím mají energie více a jsou méně vázány jádrem. Vnější vrstva elektronového obalu je pro chemiky nejdůležitější a nazývá se vrstva valenční . Právě výměna elektronů z této vrstvy je podstatou velkého množství chemických reakcí. Kolik vrstev má daný atom a kolik v nich má umístěno elektronů poznáme velice snadno, stačí se podívat do PSP. Jednotlivé vrstvy odpovídají řádkům a jednotlivé elektrony políčkům v PSP.
Třeba atom kyslíku je umístěn na druhém řádku a jeho elektronový obal se tedy skládá ze dvou vrstev. Druhá vrstva musí být vrstvou valenční, a protože je kyslík umístěn v šestém políčku na řádku, bude mít 6 valenčních elektronů. Pro atom ruthenia platí, že jeho elektronový obal se skládá z pěti vrstev a na páté valenční vrstvě má ruthenium umístěno 8 valenčních elektronů.
Vždy si dávejte pozor, na co přesně se vás ptají. Zkuste odpovědět, na následující otázky:
Kolik elektronů má baryum?
Kolik valenčních elektronů má baryum?
Která vrstva elektronového obalu je valenční?
Kolik vrstev má elektronový obal barya?
(Odpovědi: 56, 2, 6, 6)
Pokud dodáme některému valenčnímu elektronu tolik energie, že překonáme sílu, kterou je přitahován k jádru, elektron elektronový obal opustí. Následkem toho bude mít částice více protonů než elektronů a získá tedy kladný náboj. Právě jsme vytvořili kation . Pokud náš uvolněný elektron jiná částice přijme, získá záporný náboj. Bude totiž mít ve svém elektronovém obalu více elektronů než protonů. Máme anion .
Doplňte do následující tabulky chybějící údaje. Výsledky naleznete na konci stránky, ale nepodvádět!
|
Částice |
Počet protonů |
Počet neutronů |
Počet elektronů |
Náboj |
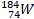
|
||||
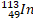
|
||||
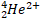
|
||||
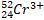
|
||||
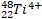
|
||||
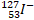
|
||||
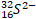
|
||||
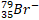
|
Počet protonů či neutronů se v chemických dějích nemění, ve fyzikálních ano. Třeba jaderná fúze, která žhaví naše slunce je založena na sloučení dvou atomů vodíku za vzniku atomu helia. Jiným příkladem je jaderné štěpení, které je podstatou jaderných bomb použitých za 2. světové války.
Na odevzdávání či přijímání elektronů valenční vrstvy stojí celá chemie. Později se to budeme učit podrobněji, takže tady jenom naznačím. Všechny prvky se snaží mít zcela zaplněnou valenční vrstvu. Přirozeně se to povedlo skupině úplně vpravo v PSP, kterým se říká vzácné plyny. Tyto prvky již nepotřebují žádné elektrony vyměňovat, valenční vrstvu mají zaplněnou, a proto jsou takřka nereaktivní. Ostatní prvky jim to závidí a chtěly by alespoň elektronově vypadat stejně. Proto třeba takový chlór se nejraději vyskytuje v podobě chloridového anionu Cl-. Získaný elektron navíc zařídí, že chlor bude elektronově odpovídat argonu a bude spokojený. Zkontrolujte si to v tabulce. Jiný případ. Třeba sodík by musel získat sedm elektronů, aby si valenční vrstvu doplnil. To je takřka nemožné. Proto zvolil odlišnou strategii. Elektronu se ochotně zbaví a bude se vyskytovat jako velmi stabilní sodný kation Na+, který bude elektronově odpovídat neonu. Prvky uprostřed PSP mají situaci nepoměrně složitější, řeší to různými způsoby a právě to činí chemii tak krásnou a pestrou.
|
Částice |
Počet protonů |
Počet neutronů |
Počet elektronů |
Náboj |
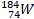
|
74 |
110 |
74 |
0 |
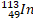
|
49 |
64 |
49 |
0 |
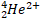
|
2 |
2 |
0 |
2+ |
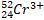
|
24 |
28 |
21 |
3+ |
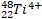
|
22 |
26 |
18 |
4+ |
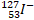
|
53 |
74 |
54 |
- |
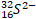
|
16 |
16 |
18 |
2- |
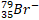
|
35 |
44 |
36 |
- |
Nyní už máme dostatek poznatků, abychom mohli trochu přesněji nadefinovat pojem prvek .
Definice: Prvek je chemicky čistá látka tvořená atomy se stejným protonovým číslem.
Počet protonů a elektronů nám jasně určuje prvek. Otázka se nabízí! Mají pro vymezení prvku nějakou roli i neutrony? No to teda! Není prvek jako prvek. Pokud máme na mysli prvek, který je složen z absolutně identických atomů, hovoříme o nuklidu prvku . Třeba nuklid uhlíku126C, je taková chemicky čistá látka, kde každý atom má Z = 6 a A = 12. Může se stát, že se jednotlivé atomy prvku budou vzájemně lišit počtem neutronů. Pak máme izotopy prvku . Třeba vodík se na planetě vyskytuje ve třech izotopech. Nejvíce zastoupený je vodík11H, který obsahuje jeden proton v jádře a jeden elektron ve svém elektronovém obalu. Máme ale i izotop vodíku21H, který kromě jednoho protonu obsahuje v jádře i jeden neutron. Tento vodík se často nazývá jako deuterium a je základem tzv. těžké vody D2O, která se používá v jaderných elektrárnách. Třetím izotopem vodíku je tritium31H, které má v jádře proton a dva neutrony. Z tritia se dříve dělaly svítící ručičky hodinek, ale v současnosti již nemá příliš významné využití.
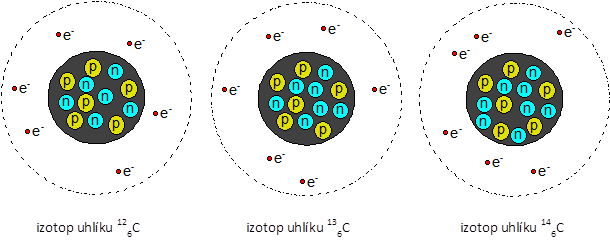
Tři nejvýznamnější izotopy uhlíku. Celkem jich bylo připraveno již 16. Izotop vpravo na obrázku je radioaktivní a používá se pro datování archeologických nálezů.
Odpověď 12: Z fyziky už víte, že opačné náboje se přitahují, shodné odpuzují. Kdyby atomové jádro bylo tvořeno pouze protony, jejich souhlasné kladné náboje by činily velké potíže. Neutrony tedy fungují jako taková výstelka, která drží protony trochu od sebe a významně tak jádro stabilizuje. Do protonového čísla 40 platí, že počet protonů a neutronů v jádře je přibližně stejný. U ještě těžších atomů již počet neutronů převyšuje počet protonů.
Další kapitola:4.2 Historické modely atomu
