Acidobazické titrace
V této kapitole si vysvětlíme princip jedné z nejzákladnějších analytických metod, a to acidobazické titrace. Titrace obecně se používají k určování neznámých koncentrací a existují v mnoha různých uspořádáních. My se zaměříme na určování neznámých koncentrací kyselin a hydroxidů. Představme si, že máme vzorek roztoku kyseliny chlorovodíkové, ale neznáme jeho koncentraci a rádi bychom ji zjistili. Co s tím? Zopakujme si, co všechno víme. Víme, že kyseliny reagují se zásadami a známe látky, co umí měnit barvu na základě pH prostředí. To je dobrý začátek.
Do titrační baňky odpipetujeme přesný objem našeho vzorku (V HCl ), přidáme pár kapek acidobazického indikátoru (v našem případě použijeme fenolftalein) a byretu, což je v podstatě pipeta s kohoutem, naplníme roztokem hydroxidu sodného, který jsme si předtím připravili. Protože jsme roztok hydroxidu připravovali, známe jeho koncentraci (c NaOH ). Pomalu začneme přikapávat roztok hydroxidu z byrety do vzorku v titrační baňce. Co se bude dít? Na začátku titrace byl v titrační baňce pouze vzorek kyseliny chlorovodíkové, a proto bude fenolftalein bezbarvý. Přikapáváním roztoku hydroxidu z byrety začne kyselina s hydroxidem reagovat a pH roztoku v titrační baňce bude pozvolna stoupat. Za chvilku nastane okamžik, kdy jsme tam pustili takové množství hydroxidu, že právě všechna kyselina zreagovala. Další kapka hydroxidu prudce zvýší pH. V tento moment okamžitě zareaguje indikátor změnou barvy, roztok ihned zfialoví a my přestaneme titrovat. Z byrety snadno odečteme množství přidaného hydroxidu (V NaOH ) a jdeme počítat.
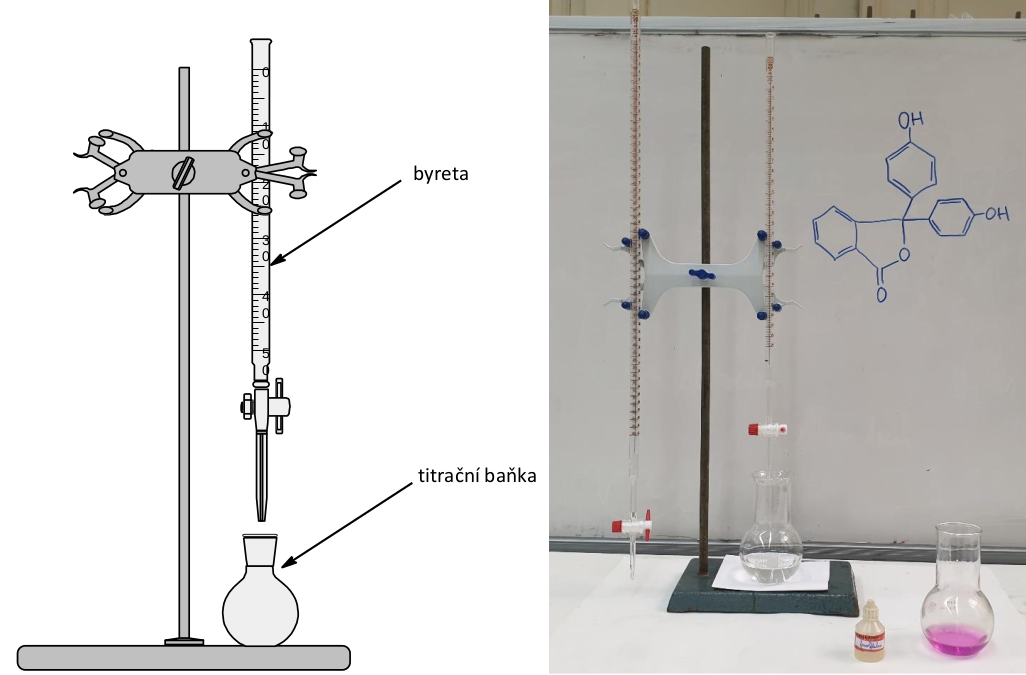
Nákres a fotografie titrační aparatury.
Známe V HCl , c NaOH , V NaOH a rovnici reakce
NaOH + HCl → NaCl + H 2 O
Z rovnice plyne, že pro reakci potřebujeme stejná látková množství kyseliny a hydroxidu. Látkové množství hydroxidu spočítáme snadno. Známe koncentraci hydroxidu, vždyť jsme si ten roztok připravili sami, a známe objem hydroxidu, který jsme odečetli z byrety. Spočítáme látkové množství hydroxidu.
n NaOH = c NaOH . V NaOH
Látkové množství kyseliny je stejné jako látkové množství hydroxidu.
n HCl = n NaOH
V posledním kroku spočítáme koncentraci našeho vzorku. Objem vzorku známe, protože jsme ho pipetovali do titrační baňky.
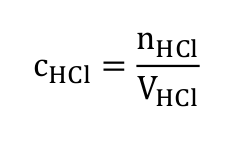
Složitější výpočet by nás čekal, kdyby kyselina byla vícesytná. Zde uvádím ukázkový výpočet pro dvojsytnou kyselinu sírovou.
Známe V H2SO4 , c NaOH , V NaOH a rovnici reakce
2 NaOH + H 2 SO 4 → Na 2 SO 4 + 2 H 2 O
Rozdíl je na první pohled patrný z rovnice. V tomto případě reagují hydroxid a kyselina v poměru 2:1, a právě tato dvojka se nám musí někde objevit ve výpočtu.
Látkové množství hydroxidu spočítáme shodně jako v předešlém případě.
n NaOH = c NaOH . V NaOH
Problém nastává nyní. Látkové množství hydroxidu bude oproti látkovému množství kyseliny sírové dvojnásobné. Matematický zápis ale vypadá následovně.
2 . n H2SO4 = n NaOH
Zamyslete se nad tím. Látková množství kyseliny a hydroxidu dáváme do rovnosti. A protože je látkové množství hydroxidu dvojnásobné oproti látkovému množství kyseliny, musíme, abychom dodrželi rovnost, látkové množství kyseliny zdvojnásobit. Poté již je výpočet stejný jako v předešlém případě.
Další kapitola:4 Mísení roztoků
