Galvanické články
Základní principy elektrochemie již známe. Některé kovy se svých elektronů rády zbaví, budou silná redukční činidla a v přírodě je pravděpodobněji najdeme v podobě jejich kationů. Jiné kovy se zase mnohem raději vyskytují v elementární podobě. Jejich kationy pak budou elektrony ochotně přijímat a ionty těchto kovů budou velmi pravděpodobně oxidační činidla. Máme to pěkně učesané a nyní to zkusíme nějak použít. Co by se asi stalo, když bychom vodivě spojili kov, který se chce zbavit elektronů, s kovem, který je chce přijmout? Velmi pravděpodobně by si potom vyšly vstříc a elektrony by si předaly. Tok elektronů nějakým drátem se přeci nazývá elektrický proud, takže pokud budeme šikovní a vhodně navolíme podmínky, dokážeme vyrobit zdroj elektrického proudu.
Vodivě spojíme měděnou elektrodu ponořenou do roztoku měďnatých iontů se zinkovou elektrodou ponořenou do zinečnatých iontů a budeme pozorovat, co se děje. Když si zkontrolujeme pozice mědi a zinku v Beketovově radě kovů, zjistíme, že měď je oproti zinku vpravo a že je dokonce ušlechtilým kovem (E°(Cu 2+ /Cu) = 0,337 V). Zinek je oproti mědi vlevo a patří mezi kovy neušlechtilé (E°(Zn 2+ /Zn) = - 0,763 V). Měďnaté ionty se tedy snaží splašit elektrony kde mohou, aby se zredukovaly a zinek se snaží svých elektronů zbavit a přeměnit se na zinečnaté kationy. Vodivým spojením těchto dvou elektrod umožníme výměnu elektronů a začnou se dít věci. Zinková elektroda se začne rozpouštět, protože zinek se bude oxidovat a vzniklé zinečnaté ionty přejdou do roztoku. Měděná elektroda začne přibývat, protože na jejím povrchu se budou redukovat měďnaté kationy z roztoku na elementární měď. A drátem poteče stejnosměrný elektrický proud. Vytvořili jsme galvanický článek, tedy článek, který v souladu s přírodními zákony vytváří elektrický proud. Naše konkrétní uspořádání uvedené na obrázku se pak nazývá po svém objeviteli Daniellův článek .
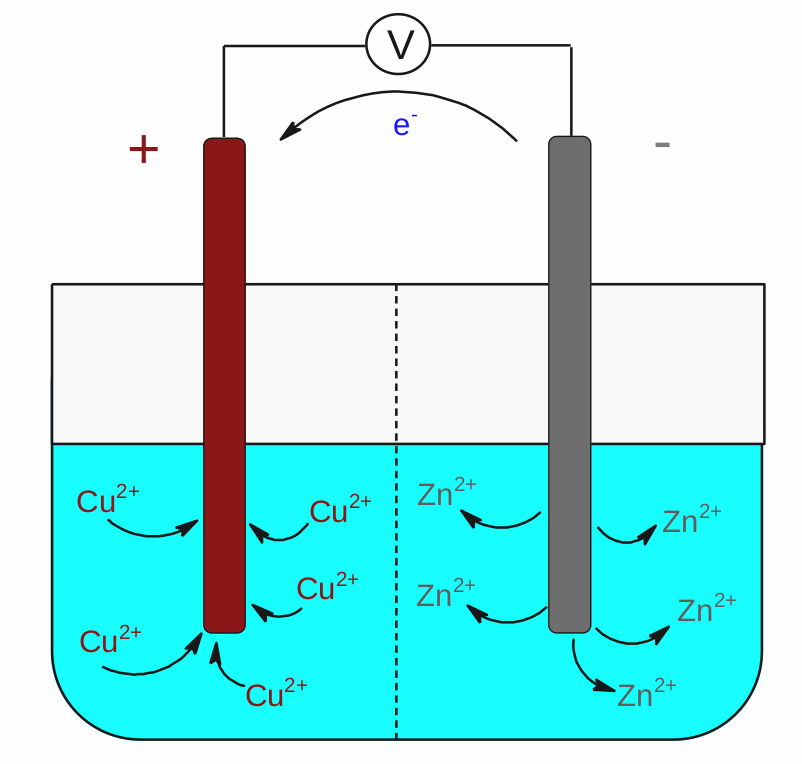
Schéma Daniellova galvanického článku.
Pozorný čtenář – obrázkář si všiml čárkované přepážky oddělující prostor jednotlivých elektrod. Jedná se o membránu, která propouští ionty tak, aby obě části roztoku zůstávaly elektroneutrální. Není totiž možné mít kladně či záporně nabitý roztok. Ten musí být vždy elektroneutrální. Jiné uspořádání je možné přes tzv. solný můstek. To je typicky skleněná trubička naplněná roztokem nějaké soli, která má stejnou funkci jako membrána, ale může být použita pro články, ve kterých jsou elektrolyty jednotlivých elektrod odděleny, třeba každý v jiné kádince.
Pojďme se ještě na chvilku zamyslet nad náboji a ději na jednotlivých elektrodách. Na drátku z mědi probíhá neustálá redukce měďnatých kationů Cu 2+ na elementární měď Cu 0 , což má za následek neustálý nedostatek elektronů a kladný náboj na této elektrodě. Měděný drátek funguje jako katoda. Drátek ze zinku je neustále nabitý záporně přebytečnými elektrony, které vznikly v důsledku oxidace zinku Zn na zinečnaté kationy Zn 2+ . Zinkový drátek je v tomto článku anoda.
Všichni pozor. Pro galvanický i elektrolytický článek platí, že elektroda, na které probíhá redukce, se nazývá katoda. Elektroda, na které probíhá oxidace, se nazývá anoda.
Ale v galvanickém článku je katoda kladnou elektrodou, anoda zápornou a v elektrolytickém článku je to obráceně.
Nabízí se otázka, zda děje popsané v galvanickém článku mohou člověku i trochu znepříjemňovat život. Jsou víceméně samovolné, jeden z kovů se mění na své kationy, je pro to potřeba jen vodivé prostředí. To se přece někde může přihodit. Po trošce přemýšlení by vás pravděpodobně napadla koroze , rezivění . Tyto procesy se nejčastěji spojují s železem, ale i ledasjaký jiný kov umí korodovat. Korozi si všichni snadno představíme. Jedná o proces, který je samovolný a jehož výsledkem je degradace (ztráta kvality) zkorodovaného materiálu. Budeme se držet toho železa a zkusíme vyjmenovat jaké faktory se musí setkat, aby nám třeba takové kovové zábradlí zrezlo. Tak předně potřebujeme ten kov. Potom je potřeba nějaké, aspoň trošku, vodivé prostředí a zejména budeme potřebovat nějaký prvek, který od oxidovaného železa přijme elektrony, tedy se redukuje. Tímto prvkem je nejčastěji kyslík obsažený ve vzduchu. Pojďme si to železné zábradlí prohlédnout z hlediska fyziky.
Redoxní potenciál kyslíku E°(O 0 /O -II ) = 1,23 V
Redoxní potenciál železa E°(Fe 2+ /Fe 0 ) = − 0, 447 V
Železo má nižší redoxní potenciál než kyslík. Kdyby kyslík byl v Beketovově řadě kovů, stálo by železo vlevo od něj. Pokud má tedy železo tu možnost, předá kyslíku elektrony a oxiduje se. Vodivé prostředí bývá tvořeno třeba roztokem síranu železnatého. Atmosférický kyslík se poté ve vodném prostředí přemění na hydroxidový anion. Další obdobné reakce mohou železnatý kation zoxidovat až na kation železitý. Schematicky si to můžete prohlédnout na následujícím obrázku.
Otázka k zamyšlení 11: Kde by se na našem zábradlí vzal roztok síranu železnatého, který tvoří vodivé prostředí?
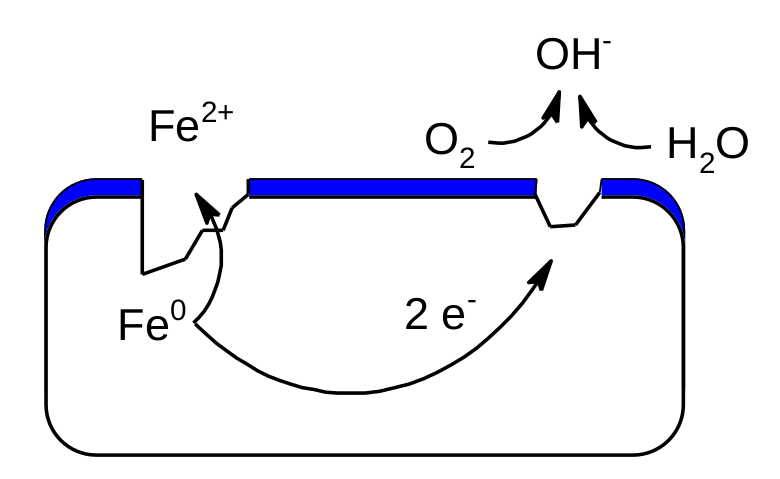
Koroze železa.
Levé místo na materiálu reprezentuje anodu (oxidace železa), pravé místo pak reprezentuje katodu (redukce kyslíku).
Zabránit korozi lze několika způsoby. Nejčastějším řešením je zabránit kontaktu kovu s vodou a se vzduchem. Toho se dá docílit třeba nátěrem . Z tohoto důvodu jsou majitelé vozů velmi rozzlobení, když mají poškrábaný lak na autě. Je totiž velmi pravděpodobné, že na poškrábaném místě začne koroze karoserie vozu. Jiný způsob ochrany proti korozi je založen na principu pokovení . Kov náchylný ke korozi je pokryt kovem, který korozi odolává. Toto všichni znáte. Představte si třeba příbory nebo vodovodní baterie. Takovými kovy jsou zinek, chrom či nikl. Jdou na to chytře. Tyto kovy velmi rychle na svém povrchu vytvoří reakcí se vzdušným kyslíkem slabou vrstvičku svého oxidu, ta pak samotný kov dokonale chrání. Procesu tvorby vrstvičky oxidu na povrchu kovu se říká pasivace . Netečným materiálem na povrchu kovu nemusí být jen korozi odolnější kov, ale i třeba sůl. Existuje postup zvaný fosfatace , kdy se na železo nanáší ochranná vrstva fosforečnanu železnatého.
Koroze jsou velmi studované téma. Zmíním pouze dva příklady z mnoha.
Nové domy či mosty se staví z železobetonu a je nutné, aby železné pruty uvnitř těchto materiálů měly dostatečnou životnost.
Korozní ochrana letadel je extrémně náročná. Nátěr letadel nejen že musí ochránit letadlo před rzí, ale musí být odolný proti velkým teplotním změnám a neméně velké mechanické zátěži.
Vymyslíte další příklady?
Odpověď 11: Odpověď je snadná. Naprší. Déšť obsahuje mnoho různých kyselin, které vzniknou v atmosféře reakcí kyselinotvorných oxidů s vodou. Kyselinotvorné oxidy jako oxid siřičitý, sírový a oxidy dusíku, vznikají různou průmyslovou činností. Třeba spalováním nekvalitního uhlí.
Otázka k zamyšlení 12: Proč vás maminka nutí pořádně vyskládat příbory v myčce?
Další kapitola:7.6.2 Elektrolytické články
