Elektrolytické články
Druhým typem článků jsou články elektrolytické. Zatímco v galvanických článcích probíhají procesy, se kterými příroda souhlasí, a proto z nich dokážeme získat energii. V elektrolytických článcích probíhají procesy proti přírodě, proto do nich musíme energii investovat, abychom přírodu přesvědčili. Elektrolytický článek od galvanického poznáme proto snadno již na první pohled. Elektrolytický článek musí mít vždy zdroj energie. Typický elektrolytický článek si můžete prohlédnout na obrázku.
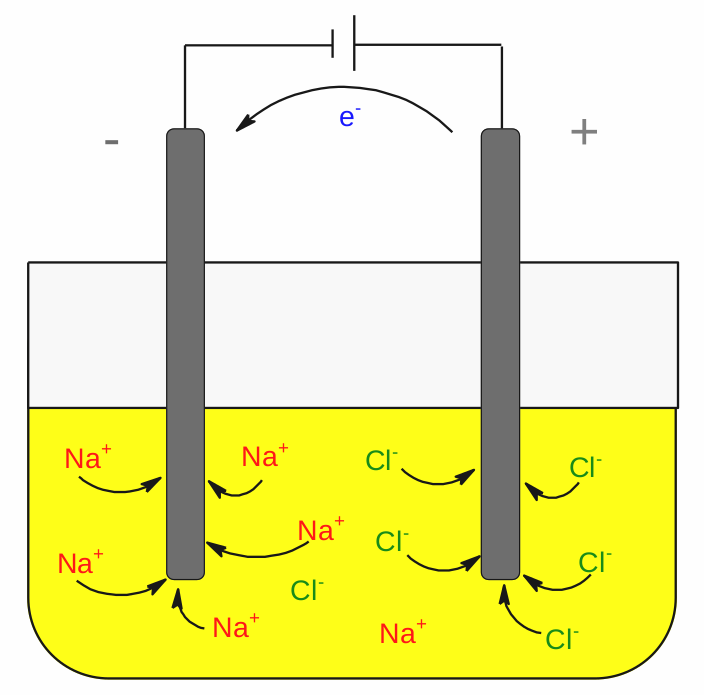
Elektrolytický článek taveniny chloridu sodného.
Elektrolytický článek se skládá ze dvou elektrod, vodivého prostředí a zdroje napětí. Materiálem elektrod bývá grafit, platina či jiný kov. Zdroj napětí na jednu z elektrod vkládá kladný náboj. Tento náboj zapříčiní, že se k této elektrodě budou přitahovat aniony. V našem případě se jedná o chloridové aniony. Jakmile Cl-dorazí k povrchu kladné elektrody, proběhne jeho oxidace dle rovnice níže a na povrchu elektrody se začne uvolňovat plynný chlór.
Kladná elektroda je tedy v elektrolytickém článku anodou.
Sodné kationy jsou přitahovány záporně nabitou elektrodou. Jakmile dospějí k jejímu povrchu, proběhne jejich redukce na elementární sodík. Záporně nabitá elektroda je v elektrolytickém článku katodou.
Odpověď 12: V myčce je velmi nevlídné prostředí. Je tam horko, velké množství mycích solí, a tak se může stát, že dva příbory při kontaktu vytvoří galvanický článek, který umožní průběh koroze, a příbory začnou rezavět.
Otázka k zamyšlení 13: Pozorný čtenář si jistě u popisku obrázku všimnul, že elektrolytem v článku je tavenina chloridu sodného, a nikoliv jeho vodný roztok. Proč tomu tak je?
Na tomto místě pro jistotu ještě jednou vysvětlíme, co to znamená „proti přírodě“. Redoxní potenciály chlóru a sodíku jsou E°(Cl0/Cl-) = 1,359 V a E°(Na+/Na0) = −2,713 V. Když bychom to tedy nechali na nich, chlor by nejraději vypadal jako chloridový anion Cl-a sodík jako sodný kation Na+. V tavenině chloridu sodného to tak již je a prvky nemají jediný důvod se nějak redoxně měnit. Abychom je donutili, musíme je přetlačit vnějším zdrojem energie.
Jinými slovy reakce
bude po dodání prvotní (aktivační) energie probíhat samovolně.
Reakce
samovolně probíhat rozhodně nebude, proto je třeba energii dodávat po celou dobu.
Elektrolýza se široce uplatňuje v průmyslové výrobě mnoha látek. Elektrolyticky se vyrábí třeba chlór či některé hydroxidy. Dále se uplatňuje v metalurgii. Třeba existuje elektrolytické čištění kovů nebo pokovování různých předmětů (chromování, zlacení). Dále samozřejmě během nabíjecí fáze akumulátorů.
Pro fanoušky autobaterií uvádím rovnice, které probíhají ve velmi populárních olověných akumulátorech, které se stále masivně uplatňují jako autobaterie.
Katodou je olověná elektroda pokrytá vrstvou PbO2. Anodou je čisté olovo a elektrolytem roztok kyseliny sírové.
Vybíjecí fáze (galvanický článek):
A (-) : Pb – 2 e-→ Pb2+ oxidace na PbSO4
K (+) : Pb4++ 2 e-→ Pb2+ redukce na PbSO4
Nabíjecí fáze (elektrolytický článek):
A (+) : Pb2+- 2 e-→ Pb4+ oxidace
K (-) : Pb2++ 2 e-→ Pb redukce
Sumárně lze oba děje popsat rovnicí:
PbO2+ Pb + 2 H2SO42 PbSO4+ 2 H2O
Odpověď 13: Pokud by byl použit vodný roztok chloridu sodného, vzniklý kovový sodík by okamžitě zreagoval s vodou za vzniku plynného vodíku a hydroxidu sodného. Tímto způsobem vzniká vodík jako odpadní produkt při výrobě některých hydroxidů.
Další kapitola:8 Výpočty z chemických rovnic
